医療関係者
抗微生物薬適正使用の手引き 第三版 別冊
目次
入院患者の感染症で問題となる微生物
(1) 黄色ブドウ球菌(MRSA[メチシリン耐性黄色ブドウ球菌]を含む)
疫学の概要と臨床的特徴
ブドウ球菌属は皮膚や粘膜に常在する菌の一種であり、健康人の鼻腔に約30%の割合で存在していると言われている。この菌は、毛のう炎等のシンプルな皮膚感染症から、骨髄炎、肺炎、感染性心内膜炎等命に関わる重篤な感染症、トキシックショック症候群といった毒素産生に関連した病態等幅広い病態を起こすことで知られている。また、細菌感染症に関連した死亡の原因菌として頻度が高い細菌である1。
なお、黄色ブドウ球菌と異なり、病原性が比較的弱いCNSが血液培養から検出された場合、本当の感染症かコンタミネーションかの評価も必要になることが多い。しかし、CNSの中でも、Staphylococcus lugdunensisは臨床的に黄色ブドウ球菌と同様に振る舞うことが知られている。このため本菌が血液培養から検出された場合には、黄色ブドウ球菌と同様の扱いが必要になる2。
以下に臨床的に重要な「黄色ブドウ球菌菌血症」という病態にフォーカスを当てて5つのポイントを述べる。
微生物学的診断
1 血液培養で検出されたら必ず「ホンモノ」として考える。
血液培養から黄色ブドウ球菌が検出された場合に、コンタミネーションによるものである可能性は1-1.5%程度と言われている3,4。黄色ブドウ球菌菌血症は感染性心内膜炎を含めた様々な病態を合併し、死亡率も高い疾患である5。このため、血液培養から黄色ブドウ球菌が検出された場合、例えそれが1ボトルだけであったとしても、コンタミネーションとは即断せずに、可能性が否定できるまでは本物の黄色ブドウ球菌菌血症として治療を行う必要がある。
治療
2 感染症医へのコンサルテーションが勧められる。
これまでの研究において、感染症専門医へのコンサルテーションは、黄色ブドウ球菌菌血症患者において、治療の質(早期感染巣コントロール、血液培養再検、心臓超音波検査、抗菌薬の正しい選択及び投与期間等)を改善するだけでなく、その結果、患者死亡率の低下、早期退院につながるという結果が示されている5。
3 黄色ブドウ球菌菌血症の評価・治療は「セット」で行う。
黄色ブドウ球菌菌血症を確認した場合、まずは「複雑性」か「非複雑性」の菌血症かの見極めが必要になる。これにより治療期間が変わるためとても大事な評価であり、以下の評価をセットで必ず行う。以下のa~eの条件すべてを満たした場合に「非複雑性」の菌血症と判断される。
a. 感染性心内膜炎の除外。
すべての患者において、心エコーを行うことが必須と考えられる。特に感染性心内膜炎ハイリスクと考えられる患者(塞栓症状のある患者、ペースメーカー留置患者、感染性心内膜炎の既往のある患者、人工弁術後の患者、静脈内薬物使用者)に関しては経食道的心エコーTransesophageal echocardiography(TEE)が必要である6。
b. 体内に異物が入っていない。
人工弁やペースメーカー/植込み型除細動器、人工関節等がないか確認する。
c. 2-4日以内に繰り返して行った血液培養が陰性である。
黄色ブドウ球菌菌血症の治療を行う場合、必ず血液培養の陰性化を確認する。また治療期間の決定という観点からは、初回陽性検体の採取日から2-4日以内に血液培養を繰り返す必要がある。
d. 適切な抗菌薬治療開始後72時間以内に解熱している。
e. 転移病巣(血行性に移行した二次感染巣)がない。
転移病巣として頻度が高いものに心臓弁、骨や関節、椎間板、硬膜外腔、それに腹腔内臓器(肝臓、腎臓、脾臓等)が挙げられる7。感染のフォーカスと考えられる部位に関しては、積極的にドレナージや除去を考える。感染したカテーテルを留置し続けることは再発のリスクを上げる7。
4 治療期間は最低2〜4週間、点滴で行う。
黄色ブドウ球菌菌血症は、その再発率の高さや疾患の性質から、一旦診断がされた場合、非複雑性菌血症の場合は「最低でも2週間点滴で」、複雑性菌血症の場合は「最低でも4週間点滴で」治療を行う必要がある8。菌血症診断時に、静脈カテーテル等抜去可能な血管内異物がある場合は、可能な限り抜去する。
5 初期抗菌薬選択の際はMRSAを念頭に
黄色ブドウ球菌が血液培養から検出され、感受性がまだわからない期間は、その菌がMRSAである可能性を念頭に抗MRSA薬(バンコマイシン等)で初期治療を行う。一方で、この際に、抗MRSA薬に加えMSSAのカバー目的にセファゾリンを併用するという考え方もある7,9。どちらのアプローチが良いかという点に関しては現時点では結論は出ていない。
表1. 黄色ブドウ球菌菌血症に用いられる抗黄色ブドウ球菌薬
| 薬剤名 | 対象 | 通常腎機能での投与量 | 特徴的な副作用 |
|---|---|---|---|
| セファゾリン7,10 | MSSA | 点滴静注1回2 g 8時間毎 | — |
| バンコマイシン11 | MRSA |
点滴静注 初回投与量1回25-30 mg/kg 維持量 1回20 mg/kg 12時間毎 TDMにより投与量調整 目標AUC 400-600 μg∙h/mL 1gでは1時間以上かけて点滴時間※ 1g以上では500 mgあたり30分以上を目安に投与時間を延長※ |
腎機能障害 バンコマイシン過敏症 DRESS レッドマン症候群※ |
| ダプトマイシン12,13 | MRSA |
点滴静注1回6-10 mg/kgを 24時間毎¶ 30分かけて※※ |
横紋筋融解症 (定期的にCK値をモニターする) 好酸球性肺炎 |
DRESS:Drug Reaction with Eosinophilia and Systemic Symptoms
※ バンコマイシンの急速な静注ではヒスタミン遊離作用によりレッドマン症候群(紅斑の出現、稀に低血圧や血管浮腫も生じうる)が起こるため投与時間に注意する。
※※ 肺サーファクタントに結合し、不活性化されるため、肺炎に対して投与しないこと。
¶ 表内は海外用量を含むため、国内添付文書用量と診療報酬支払基金の診療情報提供事例については補遺p.6参照
(2) 腸球菌(VRE[バンコマイシン耐性腸球菌]を含む)
疫学と臨床的特徴
ヒトの感染症に関連する腸球菌としてはEnterococcus faecalis、Enterococcus faecium、Enterococcus gallinarum、Enterococcus casseliflavus等があるが、臨床的に分離頻度が高いのはE. faecalisであり、次いでE. faeciumである。
腸球菌は、消化管の常在菌であり、特に重症患者や免疫抑制患者において、医療関連感染症を引き起こす。バンコマイシン耐性腸球菌(vancomycin-resistant Enterococci: VRE)による感染症は、感染症法に基づく5類感染症で全数把握対象疾患である14。
VREの国内での届け出数は2011-2019年までは年間100例未満であったが、2020年、2021年にはそれぞれ136例、124例と増加傾向であった15。
VREの大半はE. faeciumである。VREを含む腸球菌は医療施設関連UTI(特にCAUTI)の重要な原因菌であり、また、CRBSI・感染性心内膜炎・腹腔内感染症・皮膚軟部組織感染症・SSI等の原因となる16。
VRE菌血症の致命率はバンコマイシン感性腸球菌に比べ1.8倍であったとする報告もある17。
入院中の患者は院内の環境・医療従事者・デバイス等を介してVREを獲得後消化管内に保菌し、その一部が発症する。
VRE獲得のリスク因子としては、抗菌薬曝露歴(特に第3世代セファロスポリン系抗菌薬やバンコマイシン)・在院日数・重症患者・侵襲的デバイスの使用・ICU入室・長期介護施設入所・VREの保菌者や汚染された環境への曝露等が知られている16。
海外では日本国内より検出頻度が高い国も多く、海外で医療曝露歴のある患者でも検出例が散見される18。
微生物学的特徴と診断
VREでは細胞壁のペプチドグリカン前駆体末端のグリコペプチド系抗菌薬の結合親和性が低下することで耐性化する。 感染症法の届出基準では、分離腸球菌株に対するバンコマイシンのMICが16 μg/mL以上のものがVREと定義されている14。 耐性型により耐性度や各グリコペプチド系抗菌薬への感受性が異なる(補遺p.6参照)19。
治療方針
VRE感染症の治療に際しては感染症専門医への相談が推奨される。
特にVREの治療に先立って重要な点は、感染巣の特定と主要な抗菌薬(アンピシリン・テイコプラニン)への感受性並びにアレルギー歴の確認である。
感染性心内膜炎や髄膜炎の場合、抗菌薬併用療法も含めた対応が必要となるため、特に注意を要する。
膿瘍を伴う感染症やCRBSI等抗菌薬のみでの治癒は困難で、外科的ドレナージやカテーテル除去等を要する場合もある。
アンピシリン感性VREの治療において、アンピシリンは重要な薬剤である。
ペニシリンアレルギー歴を自己申告した患者のうち、実際にペニシリンが使用できないアレルギーのあった患者は少ないとされている20。
必要に応じて感染症専門医やアレルギー専門医、薬剤師による評価も行う。
VRE血流感染症(感染性心内膜炎を除く)への単剤治療の例を表にまとめた。
E. faecalisやVanC型VREはアンピシリン感性のことが多い。
また、VanB、VanC型VREでは通常テイコプラニン感性である。
これら以外のVREの治療では、ダプトマイシンやリネゾリドが抗菌薬治療の軸となる2,16。
ダプトマイシンはVRE感染症に対して添付文書上の適応はないが、殺菌的に働き各種ガイドライン等で推奨され治療に用いられている2,19,21(補遺p.6参照)。
リネゾリドは添付文書上、E. faecium感染症に適応があるが、静菌的な活性、重篤かつ頻度の高い副反応、耐性誘導、他剤に比した治療失敗率の高さ等の観点から第一選択になり難い19,22。
菌血症や感染性心内膜炎に対しては、他剤が無効もしくは薬剤耐性や副反応等で使用できない場合にのみ使用を検討する。
表2. VRE血流感染症の単剤治療の例(感染性心内膜炎を除く)2,16,19
| 感受性のパターン | 例 | 薬剤と正常腎機能の場合の 用法用量(例) |
重要な副作用 |
|---|---|---|---|
| 1.アンピシリン感性 |
E. faecalis、VanC型 (E. gallinarum、 E. casseliflavus) |
アンピシリン点滴静注 1回2 g 4-6時間毎¶ |
— |
|
2. アンピシリン耐性かつ テイコプラニン感性 |
VanB型E. faecium | テイコプラニン点滴静注¶ 体重毎の用量設定かつ ローディング投与必要。 |
腎機能障害、 テイコプラニン過敏症、 第8脳神経障害、 血球減少等 |
|
3. アンピシリン耐性かつ テイコプラニン耐性 |
VanA型E. faecium |
ダプトマイシン点滴静注 1回8-12 mg/kg 24時間毎¶ 30分かけて リネゾリド点滴静注 (ダプトマイシンの代替薬) 1回600 mg 12時間毎 30分-2時間かけて |
筋毒性が認められることがあるので、
CK値を定期的にモニターする。 好酸球性肺臓炎を生じることがあるので、 呼吸器症状、低酸素血症や 胸部異常影出現に留意する。 血球減少・神経障害 (視神経障害を含む)・ 乳酸アシドーシス等を 生じることがある。 |
¶ 表内は海外用量を含むため、国内添付文書での適応症や用量に関しては補遺p.6-7参照
(3) 腸内細菌目細菌
(ⅰ) 概要
疫学の概要と臨床的特徴
腸内細菌目細菌は、消化管内の市中感染の原因となることもあるが(Salmonella属、Shigella属、下痢原性大腸菌)、消化管外の感染症の原因菌となることが多く、 すべての臓器において市中感染及び院内(医療関連)感染の両方を引き起こす可能性がある。特に大腸菌は市中のUTI等の原因菌としても重要である。 薬剤耐性の腸内細菌目細菌は病院でのアウトブレイクに関与することもあり、感染対策も重要となる2。
微生物学的特徴
近年、ゲノムシークエンスデータを用いた系統解析分類の結果、これまでの腸内細菌科細菌(Enterobacteriaceae)と同義の用語として、 より上位レベル(目:order)である腸内細菌目細菌(Enterobacterales)を使用することが提唱された23。 腸内細菌目細菌はブドウ糖を発酵的に分解し、オキシダーゼ試験が陰性の通性嫌気性のグラム陰性桿菌であり、 ヒトの感染症に関与する多くの細菌が含まれる24。入院患者における感染症において頻度等の点から代表的な菌を補遺の表に示した(補遺p.7参照)。 多くの抗菌薬耐性メカニズムを有し、特にβ-ラクタマーゼ産生によるβ-ラクタム系抗菌薬耐性(ペニシリナーゼ、ESBL、カルバペネマーゼ、AmpC、β-ラクタマーゼ産生等)、 キノロン耐性等が問題となっている。
治療方針
原則的に薬剤感受性に応じた治療を行う。経験的に治療を開始する場合には、 JANIS(Japan Nosocomial Infections Surveillance:院内感染対策サーベイランス事業)の 各医療機関に対する還元情報PDFに含まれるアンチバイオグラムを参考にする (J-SIPHE[Japan Surveillance for Infection Prevention and Healthcare Epidemiology:感染対策連携共通プラットフォーム]の還元情報でも作成が可能)。ESBL産生菌、AmpC産生菌、Carbapenem-resistant Enterobacterales (CRE)の治療の詳細は各項目に記載した。
(ⅱ) ESBL(基質特異性拡張型β-ラクタマーゼ)産生腸内細菌目細菌
疫学と臨床的特徴
ESBL(基質特異性拡張型β-ラクタマーゼ:extended-spectrum β-lactamase)は、通常、ペニシリン系、第1-3世代セファロスポリン系、モノバクタム系抗菌薬 は分解できるものの、セファマイシン系やカルバペネム系抗菌薬は分解できず、クラブラン酸等のβ-ラクタマーゼ阻害剤によって阻害される特徴を持つ酵素である25。 以前はTEM型・SHV型ESBLを産生するKlebsiella pneumoniae が主であったが、2000年代以降はCTX-M型のESBL産生大腸菌が主体となっている26。 JANISの2021年のデータでは、全国の医療機関の入院患者におけるセフォタキシム耐性のE. coliとK. pneumoniae、Proteus mirabilisの割合は各々26.8%、11.7%、19.6%であり、 セフォタキシム耐性各菌の多くがESBL産生腸内細菌目細菌(以下、ESBL産生菌)であると考えられる27。 また、外来検体においてもE. coliの17.7%はセフォタキシム耐性であり28、ESBL産生大腸菌の市中への拡大が問題になっている。 臨床像としてはUTIが最も多く、肝胆道系感染症を始めとした腹腔内感染や、それらに起因する敗血症を呈することもある。 頻度は下がるが肺炎や皮膚軟部組織感染症の原因菌ともなりえる。 これまでに知られている感染リスク因子には過去1年以内の抗菌薬使用歴、長期療養型等の施設滞在歴、入院歴やICU滞在歴、医療デバイス留置歴、海外渡航歴(特に南アジア・東南アジア)等があるが29-31、市中での感染リスク等不明な点も少なくない。
微生物学的診断
ESBL産生の有無を確認することが推奨されており、その基準も定まっている菌種は、E. coli、Klebsiella oxytoca、K. pneumoniae、P. mirabilisであるが32、 これ以外の腸内細菌目細菌をはじめとするグラム陰性桿菌にも多く存在する。 第3世代セファロスポリン系抗菌薬(セフォタキシム、セフポドキシム、セフタジジム等)に耐性を示した腸内細菌群でカルバペネム系や セファマイシン系抗菌薬に対して感受性がある菌に関して注意が必要となる。上記の4菌種はESBLの阻害剤を用いた確認試験にて診断を行う33。
治療方針
ESBL産生菌が喀痰・ドレーン先端等の無菌的でない検体から検出された際は、必ずしも感染を起こしているとは限らず、単に保菌しているのみ(無症候性保菌)の場合もある。 また、無症候性細菌尿に関しても、特殊な患者背景(妊婦、泌尿器科的侵襲的処置前、腎移植1か月後以内)のない場合は通常治療対象とはならない34。 ESBL産生菌による感染症の場合、特に重症例・免疫不全者等ではカルバペネム系抗菌薬が推奨される。 一方でカルバペネム系抗菌薬の使用はカルバペネム耐性菌保菌のリスクを増やす可能性もあり35、 使用可能な状況ではカルバペネム代替療法の使用も検討する。治療薬に関する既存のエビデンス等の詳細は別に示した(補遺p.8参照)。 経口薬に関しては、特にフルオロキノロン系抗菌薬に対しては耐性を示す場合が多いため、感受性が確認された場合のみ使用を行う。 UTIに対する経口カルバペネム・ペネム系抗菌薬の有効性を示唆する研究もあるものの36,37、ESBL産生菌に対する有効性の評価としては十分とは言えず、また、国内では適応外使用となることもあり、現状では積極的な使用は推奨されない。
表3. ESBL産生腸内細菌目細菌感染症の治療例38-41
| 血流感染症 | |
|---|---|
|
<重症例・免疫不全例・CRBSI等> メロペネム点滴静注1回1 g 8時間毎 <非重症のUTI・十分にドレナージをされた胆道系疾患等> セフメタゾール点滴静注1回1 g 8時間毎 |
|
| 非血流感染症 | |
| 非複雑性膀胱炎 |
スルファメトキサゾール/トリメトプリム(ST合剤)2錠(トリメトプリム[80 mg/錠]
として160 mg)/回、1日2回経口投与 クラブラン酸/アモキシシリン(250 mg)1錠/回 + アモキシシリン(250 mg)1錠/回、 1日3回経口投与42 |
| 腎盂腎炎・複雑性UTI |
<経口摂取可能な例> レボフロキサシン500-750 mg/回、1日1回経口投与¶43 ST合剤2-4錠/回(トリメトプリム[80 mg/錠]として4-6 mg/kg/回)、1日2回経口投与¶44 <経口摂取不可能な例> レボフロキサシン点滴静注 1回500-750 mg、24時間毎¶43 点滴時間 500 mgの場合は1時間 FDAの添付文書では750 mgの場合90分以上かけてと記載 セフメタゾール点滴静注 1回1 g、8時間毎 |
| その他の感染症(肺炎・腹腔内感染症等) |
<重症例・免疫不全例等> メロペネム点滴静注 1回1 g、8時間毎 <非重症例・十分なドレナージをされた例等> セフメタゾール点滴静注 1回1 g、6-8時間毎 レボフロキサシン点滴静注 1回500-750 mg、24時毎¶43 点滴時間 500 mgの場合は1時間 FDAの添付文書では750 mgの場合90分以上かけてと記載 <非重症例・十分なドレナージをされた経口摂取可能な例> レボフロキサシン 500-750 mg/回、1日1回 経口投与¶43 ST合剤 2-4錠/回(トリメトプリム[80 mg/錠]として4-6 mg/kg/回)、1日2回 経口投与¶44 |
A. 用量に関しては腎機能正常例のものを提示した。腎機能に合わせた調整を要する。腎機能正常であれば、アミノグリコシド系抗菌薬も選択肢になりうる(AmpC産生腸内細菌目細菌の項参照)。
B. レボフロキサシン、ST合剤、クラブラン酸/アモキシシリン、アモキシシリンは耐性である可能性あり、必ず感受性を確認してから使用する。ST合剤に関しては点滴静注での投与も可能(AmpC産生腸内細菌目細菌の項参照)。
C. セフメタゾールに代わり、フロモキセフも使用可能だがヒトでのESBL産生菌治療に関する用法用量に関するデータがセフメタゾール39より少ない。フロモキセフ使用時はシミュレーションデータに基づき点滴静注1回1 g 6時間毎が推奨される38。
D. 治療期間は原疾患とその経過に応じて決定する。
¶ 表内は海外用量を含むため、国内添付文書での適応症や用量に関しては補遺p.8参照
(ⅲ) AmpC産生腸内細菌目細菌
疫学の概要と臨床的特徴
AmpC遺伝子を染色体にコードする代表的な腸内細菌目細菌としては、Enterobacter cloacae、 Klebsiella aerogenes、Citrobacter freundii、Serratia marcescens、Morganella morganii、Providencia rettgeri、Hafnia alvei等がある。
染色体性AmpC産生腸内細菌目細菌(以下、染色体性AmpC産生菌)感染症の最大の特徴は、治療前に第3世代以下のセファロスポリン系抗菌薬に感受性があったとしても、同剤で治療中に耐性化してしまい、最終的に治療に失敗する可能性がある、という点である。臨床研究での治療中の耐性化率は、最大でも約20%程度45であり、また耐性化する(つまり、微生物学的な治療失敗)ことが、臨床的に治療に失敗するということを意味するわけではない46。第3世代セファロスポリン系抗菌薬に曝露した場合に耐性化するリスクは、前述の染色体性AmpC産生菌の菌種間でも差があり、具体的にはE. cloacae、K. aerogenes、C. freundiiの3菌種ではリスクが高い一方47で、それ以外の菌種では、相対的にリスクが低いか、あるいはリスクがどの程度なのかまだよく分かっていない。
また、AmpC遺伝子を染色体にコードしていないKlebsiella pneumoniae、Klebsiella oxytoca、Proteus mirabilisあるいは染色体にコードしていてもそれが臨床的に問題となることが殆どないEscherichia coli等の菌種でも、プラスミドを筆頭とする可動遺伝因子を介して、染色体性AmpC産生菌由来のAmpC遺伝子を獲得する場合がある。これらのプラスミド性AmpC産生菌は、原則的に感受性検査では第3世代以下のセファロスポリン系抗菌薬に非感性を示す。
微生物学的診断
プラスミド性にAmpCを産生しうるE. coli、K. pneumoniae、K. oxytoca、P. mirabilis等の菌種では、第3世代セファロスポリン系抗菌薬に非感性を示した場合、ESBLとの鑑別が必要になる。ESBLの場合、セファマイシン系やオキサセフェム系抗菌薬に高度感性を示す一方で、プラスミド性AmpCでは多くの場合、非感性を示す。スクリーニング陽性株に対しては、表現型検査や遺伝子検査にて確認検査を行う(補遺p.9参照)。
治療方針
染色体性AmpC産生菌が第3世代セファロスポリン系抗菌薬に感性を示した場合、前述のAmpC過剰産生のリスクが高いE. cloacae、K. aerogenes、C. freundiiが原因菌の場合、治療中の耐性化が懸念される。さらに既存の観察研究は耐性化のみに主眼が置かれており、臨床予後を評価した研究が極めて限られているため、膀胱炎等軽症のUTIを除いて、第3世代セファロスポリン系抗菌薬を治療に用いることは推奨されない。
一方で、それ以外のS. marcescens、M. morganii、P. rettgeri、H. alvei等が原因菌の場合、原則的に感性に従った抗菌薬選択が可能である41。但し、これらの菌種でも、菌量が多く、ドレナージ等による感染巣のコントロールが困難な場合には、感性であっても第3世代セファロスポリン系抗菌薬の使用は慎重に検討する必要がある。
第4世代セファロスポリン系抗菌薬であるセフェピムは、AmpC過剰産生株に対しても活性が安定しており、観察研究では染色体性AmpC産生菌感染症において、カルバペネム系抗菌薬と同等の治療成績が報告されている48。但し、染色体性AmpC産生菌において、セフェピムのMICが感性域(≤2 μg/mL)にない場合には、ESBL産生菌の可能性があり、確認検査でESBL産生菌と判定された場合には、セフェピムは選択肢とならない(補遺p.9-10参照)。
タゾバクタム/ピペラシリンは、染色体性AmpC産生菌菌血症においてメロペネムと比較したRCT49で、臨床的及び微生物学的転帰の複合アウトカムで予後に差を認めなかったが、症例数が少なく(両群併せて72例)、決定的な結論は得られず、今後のより大規模なRCTが待たれる状況である。一部の観察研究では、染色体性AmpC産生菌菌血症において、カルバペネム系抗菌薬よりもタゾバクタム/ピペラシリンで死亡率が上昇することが報告されているため50,51、特に重症感染症でのタゾバクタム/ピペラシリンの使用は慎重に検討する必要がある。
非β-ラクタム系抗菌薬はAmpCの影響を受けないため、染色体性AmpC産生菌感染症であっても、感受性さえ確認できれば、ST合剤やフルオロキノロン系抗菌薬は全身感染症、アミノグリコシド系抗菌薬はUTIにおいて、有効な治療選択肢となる。特にST合剤やフルオロキノロン系抗菌薬は経口吸収率も高いため、早期の経口抗菌薬への切り替えを目指す際にも利用できる52。いずれの状況であれ、判断困難な場面では感染症専門医や院内のASTへのコンサルトを推奨する。
表4. AmpC産生腸内細菌目細菌感染症の治療例41
| 抗菌薬名 | 推奨投与量 | 菌種A※※ | 菌種B※※ |
|---|---|---|---|
| セフトリアキソン | 点滴静注 1回1-2g 12-24時間毎 | × | △ |
| セフェピム (MICが≤2 μg/mL) |
点滴静注 1回1-2g 8時間毎 ¶53,54 | 〇 | 〇 |
| タゾバクタム/ ピペラシリン |
点滴静注 1回4.5g 6時間毎 ¶49 | △ | △ |
| メロペネム | 点滴静注 1回1g 8時間毎 | 〇 | 〇 |
| レボフロキサシン |
点滴静注 1回500-750 mg 24時間毎/経口¶44,45 点滴時間 500 mgの場合は1時間 FDAの添付文書では750 mgの場合90分以上かけてと記載 |
〇 | 〇 |
| ST合剤 |
膀胱炎(経口投与): 2錠/回(トリメトプリム[80 mg/錠]として160 mg/回)、1日2回 その他の感染症: <経口投与> 2-4錠/回(トリメトプリム[80 mg/錠]として4-6 mg/kg/回)、1日2回¶44 <点滴静注> 2-4アンプル(トリメトプリム[80 mg/アンプル]として 4-6 mg/kg/回)を12時間毎¶ |
〇 | 〇 |
| アミカシン |
膀胱炎: 15 mg/kg/回 単回点滴静注 その他の感染症: 初回20 mg/kgで点滴静注後、 TDM(peak/ MIC 8-10、トラフ値 < 5 μg/mL)41 |
〇 | 〇 |
※ 留意点を含む詳細は補遺p.10-13参照
※※ 菌種A:AmpC過剰産生のリスクが相対的に高い菌種(E. cloacae, K. aerogenes, C. freundii等)、菌種B:AmpC過剰産生のリスクが相対的に低いか、リスクの程度がよく分かっていない菌種(S. marcescens, M. morganii, P. rettgeri, H. alvei等)
¶ 表内は海外用量を含むため、国内添付文書での適応症や用量に関しては補遺p.10-13参照
表5. AmpC産生腸内細菌目細菌治療薬の推奨例(詳細は上記並びに補遺p.10-13参照)
|
推奨薬 (各薬剤への感受性を確認、セフェピムはMIC<=2 μg/mL) |
AmpC過剰産生のリスクが相対的に高い菌種 (E. cloacae、K. aerogenes、C. freundii等) |
AmpC過剰産生のリスクが相対的に低いか、リスクの程度がよく分かっていない菌種 (S. marcescens、M. morganii、P. rettgeri、H. alvei等) |
|---|---|---|
| 第一推奨薬 | セフェピム、ST合剤、レボフロキサシン、アミカシン(UTI) | セフェピム、ST合剤、レボフロキサシン、 アミカシン(UTI) |
| 第一推奨薬に感性がない場合 | メロペネム | メロペネム |
| 代替治療薬 | タゾバクタム/ピペラシリン | セフトリアキソン、 タゾバクタム/ピペラシリン |
(ⅳ) CRE(カルバペネム耐性腸内細菌目細菌)
疫学の概要と臨床的特徴
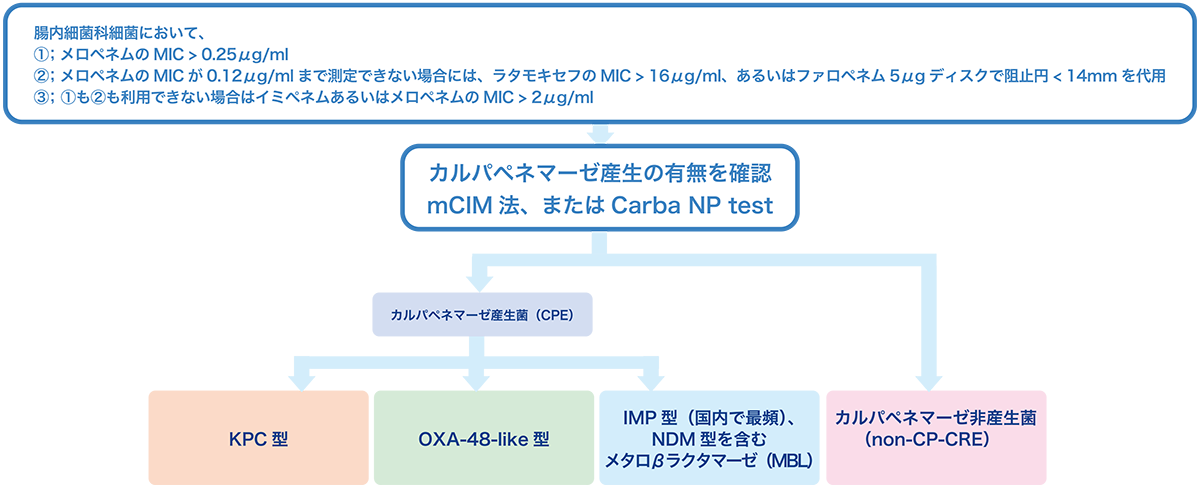
カルバペネム耐性腸内細菌目細菌(carbapenem-resistant Enterobacterales: CRE)感染症は5類全数届出疾患である56。 日本で分離されるCREのうちの約16-17%がカルバペネマーゼ産生腸内細菌目細菌(carbapenemase-producing Enterobacterales: CPE)であり、 残りの80%以上はカルバペネマーゼ非産生のカルバペネム耐性腸内細菌目細菌(non-carbapenemase-producing Enterobacterales: non-CP-CRE)である。 カルバペネマーゼにはいくつかの酵素型があり、国内で最も分離頻度が高いのはメタロ-β-ラクタマーゼ(metallo-β-lactamase: MBL)に分類されるIMP型でありCPEの85-90%を占める57。 一方、海外で頻度が高いのはNDM型、VIM型、KPC型、OXA-48-like型等である57。CRE獲得(定着/感染いずれも含む)のリスク因子は補遺p.14参照。 CRE感染症において、最も頻度の高い感染臓器はUTIであり、菌血症、気道感染症と次ぐ27,57。国内のCRE感染症での死亡率は15-20%程度と、他国と比較して死亡率が低い傾向がある58,59。
微生物学的診断
CRE感染症において、カルバペネマーゼ産生の有無を確認することによってCPEとnon-CP-CREを識別して、治療を変更すべきなのかどうか、また予後が異なるのかどうかという議論に関してはまだ結論がついていない60。
また、西日本を中心に分離頻度が高く、イミペネムに感性を示すIMP-6産生株61のような、カルバペネム系抗菌薬に感性を示すCPEによる感染症に対してカルバペネム系抗菌薬で治療した場合にどのような予後が得られるのかはまだ分かっておらず60、
治療中に耐性化し治療に失敗するリスクがあるとされる62。したがって、カルバペネム感性株であったとしても可能な限りカルバペネマーゼ産生の有無を評価することが望ましく、CPEのスクリーニング基準としてはメロペネムのMIC≥0.25 μg/mLが推奨される63。
スクリーニング基準を満たした株に対してはmCIM法、あるいはCarba NP法で確認検査を行う32。
これらの検査でカルバペネマーゼ陽性と判断された株に対しては、mCIM法とeCIM法を組み合わせてMBLかどうかの判定を行うか、あるいはイムノクロマトグラフィー法や遺伝子検査法(PCR法、マイクロアレイ法)を用いて具体的な酵素型を判定する(図1)。
治療方針
1 総論
CRE感染症で治療に難渋する最大の理由は、カルバペネムを含めた既存のβ-ラクタム系抗菌薬に広範な耐性を示すためである。
そのために、米国では2015年以降、Ceftazidime-AvibactamやMeropenem-Vaborbactam、レレバクタム/イミペネム/シラスタチン、Cefiderocol等、いずれも米国で最も頻度の高いCPEに対して活性を有する複数の新規β-ラクタム系抗菌薬が開発されて市場に導入されてきた背景がある。
一方で、レボフロキサシンやST合剤等の非β-ラクタム系抗菌薬への感性が確認された場合には、カルバペネム感性腸内細菌目細菌による感染症と同様、治療に利用できる。既に、腸内細菌目細菌菌血症55、あるいはESBL/AmpC産生腸内細菌目細菌菌血症52では、特に軽症例において、経口吸収率の高いフルオロキノロン系抗菌薬やST合剤による経口ステップダウン治療を行っても、静注抗菌薬によって治療を継続する場合と比較して予後は悪化しないことが明らかとなっている。
問題となるのは、レボフロキサシンやST合剤に対して非感性の場合であり、コリスチンやチゲサイクリン、アミノグリコシド系、ホスホマイシン点滴静注等の臨床的有効性が確立しておらず、かつ有害事象の頻度も高い、バランスに欠いた非β-ラクタム系抗菌薬(以下、これら4系統の抗菌薬を既存薬と呼ぶ)を利用しなければならなくなる。
CRE感染症において、新規β-ラクタム系抗菌薬が利用できない状況下での併用療法の有用性に関してはまだ議論は決していない。(詳細は補遺p.14-15参照)64仮に併用療法を行う場合でも、どの抗菌薬の併用が優れているのかを示したデータは殆どなく、特に日本で頻度の高いMBL産生CPE感染症(あるいはnon-CP-CRE感染症)に特化して、併用療法と単剤治療を比較したデータはない(詳細は補遺p.14-15参照)65。
なお、日本のCRE感染症は大半が単剤で治療されており58、症例数は限定されるが併用療法による死亡率の低下は確認されていない。
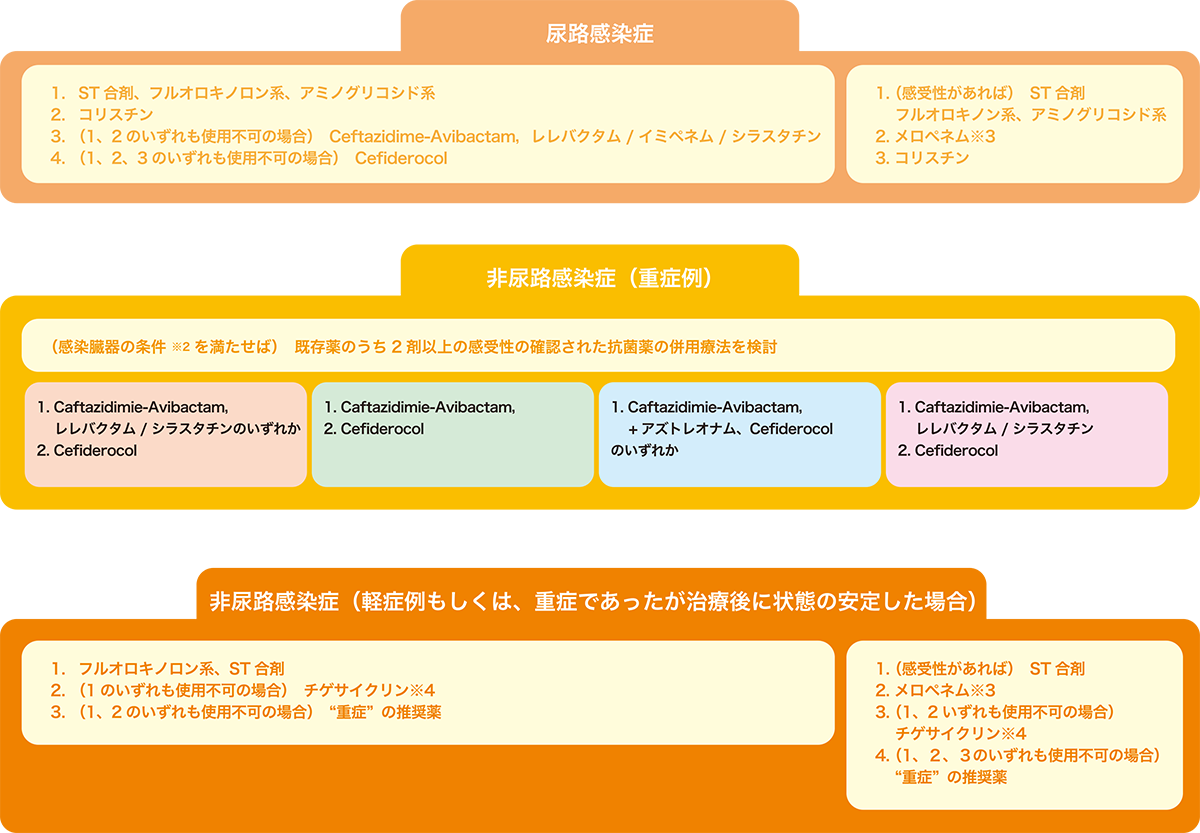
まとめると、日本のCRE菌血症では、尿路感染症や非尿路感染症の軽症例、さらには重症例であっても経静脈抗菌薬治療によって状態が安定した後の経口ステップダウン治療において、フルオロキノロン系抗菌薬やST合剤等の抗菌薬単剤での治療を検討できない合理的な理由はない。
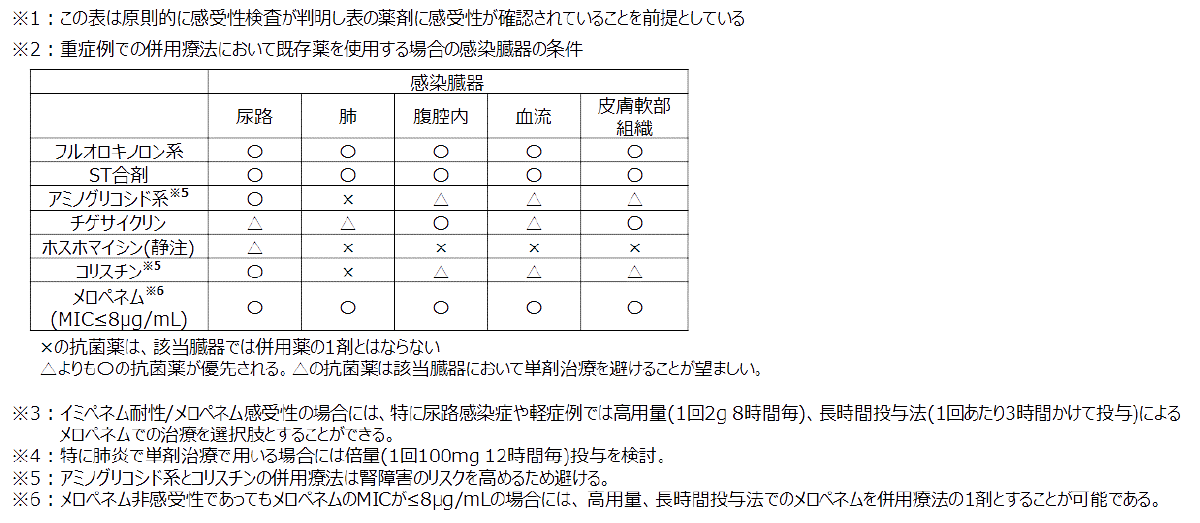
一方で、非尿路感染症や重症例で新規β-ラクタム系抗菌薬が利用できず、フルオロキノロン系抗菌薬やST合剤、あるいは既存薬を利用せざるを得ない場合には、臨床的有効性がまだ十分に確立していないために単剤治療よりも併用療法が提案される66。但し、一旦状態が安定した後は、有害事象のリスクを考慮して単剤治療への変更を検討する。
2 日本におけるCPE感染症での治療戦略(図1)
欧州臨床微生物・感染症学会(European Society of Clinical Microbiology and Infectious Diseases: ESCMID)による多剤耐性グラム陰性桿菌治療ガイドライン66及び米国感染症学会(Infectious Diseases Society of America: IDSA)による多剤耐性グラム陰性桿菌治療ガイダンス41のいずれも、IMP型を含むMBL産生CPE感染症では、Ceftazidime-Avibactamとアズトレオナムの併用療法、あるいはCefiderocol単剤治療を推奨している(2023年7月17日時点で、Ceftazidime-Avibactam及びCefiderocolのいずれも使用できない)。Cefiderocolは、IMP型やNDM型を含むMBL産生CPEによる感染症において、現存する唯一の単剤で治療可能なβ-ラクタム系抗菌薬であり、その活性をMBL産生CPEに対して温存するために、MBL産生以外のCPE感染症、non-CP-CRE感染症での使用は極力控えるべきである。
国内で主流のCPEであるIMP型67産生株と(米国で主流の)KPC型68産生株を、抗菌薬感受性という視点で比較した場合の最大の相違点は、IMP型は非β-ラクタム系の抗菌薬、具体的にはST合剤やフルオロキノロン系、アミノグリコシド系抗菌薬の感性が維持されやすいという点である。
したがって、非尿路感染症であればフルオロキノロン系抗菌薬やST合剤、尿路感染症であればこれらに加えてアミノグリコシド系抗菌薬を治療選択肢とすることができ58,69、実際の治療経験でも最も頻度の高い選択肢となっている67。
3 non-CP-CRE感染症での治療戦略
non-CP-CREのカルバペネム耐性機序は補遺p.15参照のこと。抗菌薬non-CP-CRE感染症でもCPE感染症と同様に、感受性が確認できているかぎり、非β-ラクタム系抗菌薬を治療に利用することができる。加えて、CPE感染症との相違点として、イミペネムにのみ非感性でメロペネムには感受性を示すnon-CP-CRE感染症では、(特に軽症例や尿路感染症において)長時間投与法によるメロペネムを治療選択肢とすることができる41。 また、2023年7月17日時点で日本でも利用できる新薬レレバクタム/イミペネム/シラスタチン70,71(及びCeftazidime/Avibactam、Cefiderocol 72)はnon-CP-CRE感染症に対する活性が維持されることが報告されており、他の抗菌薬が利用できない場合に限定して、治療選択肢となるかもしれない。
表6. カルバペネム耐性腸内細菌目細菌感染症の治療例41
| 抗菌薬名 |
推奨投与量 (肝腎機能正常者) |
In vitroでの活性 | |
|---|---|---|---|
| Non-CP-CRE | CPE(IMP型を想定) | ||
| レボフロキサシン | AmpC産生腸内細菌目細菌の項を参照 | 〇 | 〇 |
| ST合剤 | AmpC産生腸内細菌目細菌の項を参照 | 〇 | 〇 |
| アミカシン | AmpC産生腸内細菌目細菌の項を参照 | 〇 | 〇 |
| コリスチン※※ |
点滴静注 初回900万単位(300 mgに相当)を 負荷投与後、1回450万単位(150 mgに相当) 12時間毎投与73 30分以上かけて点滴静注¶ |
〇 | 〇 |
| チゲサイクリン※※ |
点滴静注 初回100-200 mg 単回投与後、 1回50-100 mg 12時間毎¶74 30-60分かけて75 |
〇 | 〇 |
|
メロペネム (イミペネム/ シラスタチン耐性でもメロペネムに感性の場合) |
膀胱炎: 点滴静注1回1 g 8時間毎 (1回あたり30分かけて投与) その他の感染症: 点滴静注1回2 g 8時間毎 ¶76,77 (1回あたり3時間かけて投与する長時間投与法を検討) |
△ | × |
| レレバクタム/ イミペネム/ シラスタチン |
点滴静注1回1.25 g 6時間毎 (1回あたり30分かけて投与) |
〇 | × |
※ 留意点や臨床効果と安全性のバランスを含む詳細は補遺p.16-19参照
※※ チゲサイクリン及びコリスチンの使用に当たっては、日本化学療法学会が適正使用に関する指針をそれぞれ公開している78,79
¶ 表内は海外用量を含むため、国内添付文書での適応症や用量に関しては補遺p.16-19参照
CREの診断と標的治療のフローチャート※1
以下3つのすべてに合致する場合、「非重症例」の判断の目安とする。いずれか1つ以上に合致しない場合、「重症例」の判断の目安とする。
表7. 非尿路感染症の重症例と非重症例の判断の目安80-84
| 血行動態が安定化している |
|---|
<例>
|
| 免疫不全がない(もしくはあっても患者の状態が安定している) |
<例>
|
| ソースコントロールができている |
<例>
|
【非尿路感染症(重症例)の具体例】
- 症例1:直腸癌 Stage IIIaで術前化学療法後の根治目的で直腸切除術施行された50代男性。術後縫合不全により二次性腹膜炎を来たし敗血症性ショックに至った。血液培養と腹腔ドレーン挿入時(腹水)の培養からIMP型のCPEが分離された。
- 症例2:総胆管結石による急性閉塞性化膿性胆管炎により、敗血症性ショックと急性腎障害をきたした60代女性。血液培養並びに緊急胆道ドレナージ術施行時の胆汁培養よりnon-CP-CREが分離された。
- 症例3:COPDの既往のある70代男性。海外旅行中に市中肺炎に罹患し、トルコの病院のICUにて人工呼吸器管理をされた。気管切開後、日本に医療搬送された。搬送後に再度肺炎を来たし、酸素需要が出現しPaO2/FiO2比が180となった。喀痰培養より、OXA-48-like型のCPEが分離された。
- 症例4:急性骨髄性白血病で化学療法中の60代女性。好中球減少性発熱を来たし、好中球減少性腸炎を発症。血液培養よりIMP型のCPEが分離された。
- 症例5:コントロール不良な糖尿病がありインドへの頻回渡航歴のある50代男性。糖尿病性足壊疽部位への感染による壊死性筋膜炎を来たし、敗血症性ショックに至った。創部と血液培養よりNDM型のCPEが分離された。
【非尿路感染症(非重症例)の具体例】
- 症例1:パーキンソン病のある70代男性。これまでに複数回の誤嚥性肺炎の既往あり。発熱にて入院し、誤嚥性肺炎の診断となった。高CRP血症は認めるもののバイタルサインは安定しておりカヌラ1L/分の酸素投与でSpO2 97%である。喀痰からはnon-CP-CREが検出された。
-
症例2:関節リウマチにてプレドニゾロン5mg内服中の70代女性。前日からの右下腿の痛みがあり、救急外来受診。発赤あり蜂窩織炎と診断された。一部びらんになっている部位より滲出液あり。血行動態は安定しており一般病床に入院になった。
血液培養は陰性であったが、創部の浸出液のグラム染色にて白血球と腸内細菌目細菌様のグラム陰性桿菌が陽性であり、その培養からはIMP型のCPEが分離された。
【非尿路感染症(重症であったが治療後に状態の安定した場合)の具体例】
- 症例1:陳旧性脳梗塞、血管性認知症のある90代女性。仙骨部の褥瘡周囲の蜂窩織炎、皮下膿瘍、並びに仙骨骨髄炎の診断で入院。膿の培養からnon-CP-CREが検出されたが血液培養は陰性であった。入院時には敗血症性ショックの状態であったが、レレバクタム/イミペネム/シラスタチンの投与や集中治療を行い、1週間目にはバイタルサインは正常となった。
- 症例2:台湾在住、日本を観光のため訪問中の糖尿病で内服中の60代男性。発熱があり、ホテルで体動困難となり救急搬送。入院時敗血症性ショックの状態で輸液に加え昇圧剤の投与を要した。肝臓に10 cm大の肝膿瘍があり、緊急ドレナージ術を施行。入院時の血液培養と肝膿瘍ドレナージ液よりKPC産生K. pneumoniaeが分離された。留置されたドレーンからは良好な排液が得られ、2週間後には全身状態良好となった。
(4) 緑膿菌
疫学の概要と臨床的特徴
国内では薬剤耐性緑膿菌感染症は5類定点把握届出疾患85であるが、感染症法で定義される薬剤耐性緑膿菌と、世界標準での多剤耐性緑膿菌(multidrug-resistant Pseudomonas aeruginosa: MDRP)の定義は異なっている点には注意を要する(詳細は補遺p.20-21参照)。
なお、過去の薬剤耐性菌に関する定義では各抗菌薬カテゴリーの重みづけは成されておらず、効果と毒性のバランスが取れている抗菌薬(例:β-ラクタム系やフルオロキノロン系)とバランスを欠いている抗菌薬(例:アミノグリコシド系やポリミキシン系)が同列で扱われている点が臨床に落とし込む際に難点となっていたため、近年新たに難治耐性緑膿菌(difficult-to-treat resistantce P. aeruginosa: DTR-PA)という概念が提唱されている86。DTR-PAは、全β-ラクタム系抗菌薬とフルオロキノロン系抗菌薬に非感性を示す緑膿菌株、と定義される。つまり、DTR-PA感染症では、既存薬の中ではアミノグリコシド系、ポリミキシン系抗菌薬しか活性のある抗菌薬がない、ということになる。この臨床に即したDTR-PAの概念は、海外の耐性菌治療のガイダンスやガイドラインでも広く採用されている41,66。
微生物学的診断
日本における、カルバペネム(正確にはメロペネム)耐性緑膿菌の中で、カルバペネマーゼ産生株は10%未満にすぎず87最も頻度の高いカルバペネマーゼはIMP型である(詳細は補遺p.20-21参照)。IMP型に関してはメロペネムに高度耐性を示す88ため、CPEのようにカルバペネム感性のカルバペネマーゼ産生株を懸念する必要性は乏しく、原則的にカルバペネム(メロペネム)耐性でのスクリーニングが可能である。
スクリーニング陽性株に対してはmCIM法やCarba NP法32、あるいはCIMTris法89で確認検査を行う。これらの検査でカルバペネマーゼ陽性と判定された株に対しては、イムノクロマトグラフィー法や遺伝子検査法(PCR法、マイクロアレイ法)を用いて具体的な酵素型を決定する。
治療方針
以下、断りのない限り、カルバペネマーゼ非産生株であることが確認されている前提で述べる。MDRP感染症の場合、既存のβ-ラクタム系抗菌薬のいずれかに感性が保たれていれば、(たとえカルバペネム系抗菌薬に耐性であったとしても)感性の確認されたβ-ラクタム系抗菌薬を選択できる41。但し、MDRP感染症でも、感染巣のコントロールができていないか、あるいは重症の場合には、後述の新規β-ラクタム系抗菌薬も治療選択肢となる。
より治療選択肢に困るのは、DTR-PA感染症である。この場合、既存薬では、UTIを除いて臨床的有効性が確立しておらず、かつ有害事象の頻度が高いアミノグリコシド系抗菌薬とコリスチンしか選択できる抗菌薬がない。2014年以降に、海外で承認された各新規β-ラクタム系抗菌薬は、いずれもCREを中心とした耐性グラム陰性桿菌感染症において、アミノグリコシド系抗菌薬やコリスチンを中心とした既存薬による治療を比較して、臨床予後を悪化させることなく、腎障害の頻度を減らすことが示されている90。これらの抗菌薬の中で、2023年9月14日時点で日本でも利用できるのは、タゾバクタム/セフトロザンとレレバクタム/イミペネム/シラスタチンの2剤である。
既に観察研究では、耐性緑膿菌においてタゾバクタム/セフトロザンによる治療は、コリスチンやアミノグリコシド系抗菌薬を軸とした既存薬による治療と比較して、臨床的治癒率が高く、腎障害の頻度が低下することが示されている91。レレバクタム/イミペネム/シラスタチンに関しては、まだ緑膿菌感染症での臨床実績は限られるが、第3相試験のサブ解析では、イミペネム非感性緑膿菌感染症において、コリスチンとイミペネム/シラスタチンの併用療法と比較して治療奏効率が悪化することなく、腎障害の頻度は低下する可能性が示唆されている(詳細は補遺p.20-21参照)92。
いずれの薬剤も、カルバペネマーゼに依存しないカルバペネム耐性株に対して活性が維持されており、米国のデータではあるが、DTR-PA症例の約50-70%93において、これらの薬剤の感性が確認されている。緑膿菌感染症において、タゾバクタム/セフトロザンとレレバクタム/イミペネム/シラスタチンの両剤間で比較した臨床研究はまだないが、臨床経験が豊富であること、市販の検査機器で感受性を測定できること(2023年2月25日時点)を理由として、タゾバクタム/セフトロザンの方が使用しやすい。
但し、タゾバクタム/セフトロザンは使用中及び使用後に最大20%の頻度で耐性株が出現することが報告されている94。タゾバクタム/セフトロザンとレレバクタム/イミペネム/シラスタチンの交叉耐性の頻度は比較的低いため95、タゾバクタム/セフトロザン耐性株でもレレバクタム/イミペネム/シラスタチンの感性は保たれている可能性がある。なお、これらの新薬を利用する場合には、単剤治療よりも併用療法が優れているというエビデンスはなく91,96、併用療法は推奨されない。将来的には、Ceftazidime-Avibactam97,98、Cefiderocol99,100が利用できるようになれば、タゾバクタム/セフトロザンやレレバクタム/イミペネム/シラスタチンと同様にDTR-PA感染症での治療選択肢となりえる。
但し、Cefiderocolはその他の新規β-ラクタマーゼ阻害剤と異なり、既存薬との比較試験で治療予後が改善することは示されておらず99、さらにはCREの項で述べた通り、MBL産生CPE感染症において現存する唯一の単剤で治療可能なβ-ラクタム系抗菌薬であるため、他剤が利用できる場合には、Cefiderocolの使用は極力控えるべきである。
一方で、カルバペネマーゼ産生株であることが確認された場合、日本ではその多くがIMP型のMBL産生株であるため、非β-ラクタム系抗菌薬であるフルオロキノロン系やアミノグリコシド系抗菌薬と共にCefiderocolが治療選択肢となりうる101。
表8. カルバペネム耐性緑膿菌感染症の治療例41
| 抗菌薬分類 | 抗薬名 | 推奨投与量 |
|---|---|---|
| 既存のβ-ラクタム系 | ||
| セフタジジム | 点滴静注1回2 g 8時間毎 ¶102 | |
| セフェピム |
点滴静注1回1-2 g 8時間毎 ¶103 重症例では1回あたり3時間かけて投与する長時間投与法を検討103 |
|
| ピペラシリン |
点滴静注 1回4 g 6時間毎 重症例では1回あたり4時間かけて投与する長時間投与を検討104 |
|
|
タゾバクタム/ ピペラシリン |
点滴静注1回4.5 g 6時間毎 ¶ 重症例では1回あたり4時間かけて投与する長時間投与法を検討104,105 |
|
| アズトレオナム |
点滴静注1回2 g 8時間毎 106 ¶ 重症例では1回あたり3時間かけて投与する長時間投与法を検討107,108 |
|
| フルオロキノロン系 | ||
| レボフロキサシン | AmpC産生腸内細菌目細菌の項を参照 | |
| シプロフロキサシン |
膀胱炎: 1回400 mg 12時間毎 点滴静注 1時間かけて投与 あるいは、1回500 mg 12時間毎 経口投与¶44,55 その他の感染症: 1回400 mg 8時間毎 点滴静注 1時間かけて投与 あるいは、1回500-750 mg 12時間毎 経口投与¶44,55 |
|
| 新規β-ラクタム系 | ||
|
タゾバクタム/ セフトロザン |
膀胱炎: 点滴静注1回1.5 g 8時間毎 その他の感染症: 点滴静注1回1.5-3 g 8時間毎 (1回あたり1時間かけて投与) |
|
|
レレバクタム/ イミペネム/ シラスタチン |
点滴静注1回1.25 g 6時間毎 (1回あたり30分かけて投与) |
|
| アミノグリコシド系 | ||
| アミカシン | AmpC産生腸内細菌目細菌の項を参照 | |
| トブラマイシン11,41 |
膀胱炎: 5 mg/kg/回 単回点滴静注 その他の感染症: 初回7 mg/kgで点滴静注後、peak/MIC 8-10、 トラフ値< 1μg/mLになるよう調整 |
|
| ゲンタマイシン11,41 |
膀胱炎: 5 mg/kg/回 単回点滴静注 その他の感染症: 初回7 mg/kgで点滴静注後、 peak/MIC 8-10、 トラフ値< 1 μg/mLになるよう調整 |
|
| ポリミキシン系 | ||
| コリスチン | CREの項参照 |
¶表内は海外用量を含むため、国内添付文書での適応症や用量に関しては補遺p.22-24表6参照
表9. カルバペネム耐性緑膿菌治療薬の推奨例(詳細は上記並びに補遺p.24表7参照)
| 推奨薬(各薬剤への感受性を確認) | |
|---|---|
| 第一推奨薬 | セフタジジム、セフェピム、ピペラシリン、タゾバクタム/ピペラシリン、レボフロキサシン、シプロフロキサシン、アミカシン・トブラマイシン・ゲンタマイシン(UTI) |
| 第一推奨薬に感性がない場合 | タゾバクタム/セフトロザン、レレバクタム/イミペネム/シラスタチン |
| 代替治療薬 | アズトレオナム、コリスチン |
(5) その他のグラム陰性桿菌(緑膿菌以外のブドウ糖非発酵菌)
(ⅰ) アシネトバクター属
疫学の概要と臨床的特徴
Acinetobacter属は小型で通常ブドウ糖非発酵のグラム陰性桿菌であり、土壌や河川水等の環境に広く存在する109。
また、院内環境で長期に生存可能であり、院内で長期間にわたるアウトブレイクの原因となる。
Acinetobacter属の中でもヒトの感染症の原因となるのは主にAcinetobacter baumanniiである109。
A. baumanniiは院内肺炎、敗血症や創傷感染症等の原因となるが、臨床的に特に問題となるのは院内肺炎、中でもVAPである109,110。
Acinetobacter属による感染症の典型的なリスク因子として、高齢、重度の基礎疾患の存在、免疫不全、外傷や熱傷、外科治療があり、さらに、体内カテーテル挿入や人工呼吸器管理中、長期入院、抗菌薬曝露等もリスクとなる111。オーストラリアやオセアニア、中国や台湾、タイ等の温暖・湿潤な国では市中感染症(主に肺炎)の原因となることも知られているが112、日本での報告は限られる113。
A. baumanniiは内因性の薬剤耐性機構を豊富に有し、同時に外因性の薬剤耐性機構を獲得する能力も備える(詳細は補遺p.25参照)。そのため、世界的に薬剤耐性化が問題となっている109。最も大きな問題はカルバペネム耐性であり、世界保健機関は、新規抗菌薬の研究開発が急がれる薬剤耐性菌のなかで、カルバペネム耐性A. baumannii(Carbapenem-resistant Acinetobacter baumannii: CRAB)を最も緊急性の高い ”critical“ に分類している114。近年では海外で医療曝露があった症例を介して多剤耐性アシネトバクター(Multidrug-resistant Acinetobacter spp.: MDRA)が日本の医療機関に持ち込まれる事例が報告され、一部では院内でのアウトブレイクにつながっている18,115,116。そのため、海外から持ち込まれる可能性の高い薬剤耐性菌としても認識が必要である117。
微生物学的診断
国内では薬剤耐性アシネトバクター感染症は5類感染症全数把握疾患である118。発生届上の「薬剤耐性」の定義は、広域β-ラクタム系抗菌薬(基準上はカルバペネム系)・アミノ配糖体(アミノグリコシド系)・フルオロキノロン系の3系統の薬剤に対して耐性を示すことである(詳細は補遺p.25参照)118。なお、保菌者は届け出の対象にはならない。
治療方針
Acinetobacter属は院内肺炎、中でも人工呼吸器関連肺炎が主な侵襲性感染症である109,110。また、CRBSIやフォーカス不明の菌血症の原因となる119。血液培養から検出された場合は治療の適応となるが、呼吸器検体や創部検体にはよく定着するため120、臨床検体から分離された場合には、侵襲性感染症の原因となっているかどうかについて評価する2。人工物感染における人工物抜去やCRBSIにおけるカテーテル抜去等の感染巣のソースコントロールを行う。
薬剤感性が保たれていれば、β-ラクタム系抗菌薬が治療の第一選択である2,110。中でも、カルバペネム系抗菌薬が最も信頼できる薬剤と考えられており、重症感染症では第一選択とされている110,121。
また、β-ラクタマーゼ阻害剤として知られるスルバクタムが活性を有し122、感性である場合、治療の選択肢と考えられる41,121,123。日本ではアンピシリンとの合剤で使用可能である。耐性機序が異なるため、カルバペネム耐性株においてもスルバクタムに対する感性を示す場合もある123。IDSAによる治療ガイダンスでは、スルバクタム/アンピシリンがCRABの第一選択として挙げられている41。ただし、最適な投与量・投与法が不明な点が懸念として挙げられる。IDSAの推奨ではスルバクタム/アンピシリンの1日量で18-27 g(スルバクタムとして6-9 g)と、国内添付文書の記載(最大1日量12 g)を大きく上回る投与量が推奨されており41、臨床応用については留意する必要がある。
このほか、第4世代セファロスポリン系抗菌薬(セフェピム)がアシネトバクター属による菌血症に対しカルバペネム系抗菌薬と治療効果が同等であったとする多施設後ろ向き観察研究もあり124、感性を示す場合には選択肢となると考えられる。
カルバペネム耐性アシネトバクター治療の選択肢として、先述のスルバクタム以外に、テトラサイクリン(グリシルサイクリン)系抗菌薬であるチゲサイクリン、ミノサイクリンやコリスチンが挙げられるが125,126、臨床上の懸念点があり、IDSAによる治療ガイダンスでは、軽症感染症においてミノサイクリン及びコリスチンの単剤使用が考慮されるとする一方、中等症以上では感受性のある2剤以上の薬剤の併用療法が推奨されている41 。
しかし、多くのRCTにおいて単剤治療に対する併用療法の優位性が示せておらず76,127-131、さらに、コリスチン(ポリミキシン)を主軸とした併用療法が用いられることが多いが132、副作用の懸念が大きく、また、併用療法の適切な組み合わせも明確ではない。こうした状況から、中等症以上のCRABの治療に関しては院内外の感染症専門医に相談することも考慮する。治療薬に関する既存のエビデンスの詳細は補遺p.26参照。
表10. Acinetobacter属に対する抗菌薬の主な選択肢と注意点41
| 薬剤名 | 1回投与量 | 投与間隔 | 注意点 |
|---|---|---|---|
| メロペネム | 1-2 g¶ | 点滴静注8時間毎 |
|
| セフェピム | 2 g¶53 | 点滴静注8-12時間毎 |
|
| スルバクタム/ アンピシリン | 3 g(スルバクタム:1g)¶133-136 | 点滴静注6時間毎 |
|
| ミノサイクリン | 100 mg¶ | 点滴静注12時間毎 |
|
| チゲサイクリン | CREの項参照 | — | — |
| コリスチン | CREの項参照 | — | — |
¶表内は海外用量を含むため、国内添付文書での適応症や用量に関しては補遺p.26-27参照
表11. Acinetobacter属に対する治療薬の推奨例(詳細は本文並びに補遺p.26-27参照)
| 推奨薬(各薬剤への感受性を確認) | 軽症 | 中等症・重症 |
|---|---|---|
| 第一推奨薬 | セフェピム、 スルバクタム/アンピシリン、ミノサイクリン | メロペネム or セフェピム + ミノサイクリンor コリスチンor チゲサイクリン【感受性のある2剤以上の薬剤を併用】 |
| 代替治療薬 | コリスチン、チゲサイクリン | — |
(ⅱ) ステノトロフォモナス・マルトフィリア(Stenotrophomonas maltophilia)
疫学の概要と臨床的特徴
ステノトロフォモナス・マルトフィリア(以下S. maltophilia)はブドウ糖非発酵のグラム陰性桿菌である137,138。
病院内外の栄養に乏しい水生環境で生存可能で、プラスチックにも付着しバイオフィルムを形成する137。
そのため、静脈カニューレをはじめとした臨床現場で使用される人工物や、透析液、水道水、シンク等の院内環境から検出される137。
S. maltophiliaによる感染症は、CRBSIを含む菌血症、呼吸器感染症の頻度が高い138,139。
特に血液悪性腫瘍患者において、急速に進行する出血性肺炎が死亡率の高い病態として知られている140,141。その他、眼内炎、心内膜炎、髄膜炎、皮膚軟部組織感染症、インプラント関連感染症等幅広い感染症の原因として報告がある137。
S. maltophilia感染症の罹患のリスクとして、悪性腫瘍(特に血液悪性腫瘍、中でも造血幹細胞移植レシピエント)・嚢胞性線維症・HIV感染症といった基礎疾患、静脈薬物使用、事故による外傷、手術・長期入院・静脈内カテーテルや尿道カテーテルの使用、ICU入室、人工呼吸器使用、免疫抑制治療等の要因が挙げられる137。
微生物学的診断
S. maltophiliaの保菌及びこれに由来する感染症は感染症法上の届出対象ではない。日本で利用可能な薬剤感受性検査について臨床・検査標準協会(Clinical and Laboratory Standards Institute: CLSI)では、ST合剤・レボフロキサシン・ミノサイクリン・セフタジジムにおけるMICの判定基準を定めており32、一方、ヨーロッパ抗菌薬感受性試験法検討委員会(European Committee on Antimicrobial Susceptibility Testing: EUCAST)ではST合剤のみMIC値の判定基準を定めている(詳細は補遺p.27-28参照)142。
治療方針
S. maltophiliaは先述の罹患リスクのある患者において、主にCRBSIや肺炎の原因となる139。血液培養から検出された場合は治療の適応となるが、呼吸器検体にはよく定着し、特にICU入室が長い患者や濃厚な抗菌薬曝露(特にカルバペネム系抗菌薬)がある患者、気管切開後の患者では定着しやすい。
そのため、臨床検体から分離された場合、侵襲性感染症の原因となっているかどうかを評価する139。CRBSIにおけるカテーテルの抜去等の感染巣のソースコントロールを行う132,143。
抗微生物薬治療について、RCTはないものの、幅広い薬剤に対する内因性の薬剤耐性機構を備えていることと(詳細は補遺p.27-28参照)、使用経験の豊富さからST合剤が第一選択とされ、広く使用されている41,144。一方、腎障害や肝障害、輸液負荷や高カリウム血症、骨髄抑制、皮疹といった副作用がST合剤による治療の懸念点として挙げられる145,146。
IDSAによる治療ガイダンスでは、軽症例では、ST合剤、ミノサイクリン、チゲサイクリン、レボフロキサシン、それぞれ単剤での治療が可能とされ、中でもST合剤とミノサイクリンがより好ましいとしている41。
一方、フルオロキノロン系抗菌薬では治療中の耐性化のおそれ146,147、テトラサイクリン系抗菌薬では分布容積の大きさにより血中濃度が上がりにくい126、という懸念がそれぞれある。
そのため、併用療法の優位性を示す十分なデータはないものの148、中等症以上の症例ではST合剤とミノサイクリンの併用療法、もしくは、ST合剤単剤で開始した上で十分な治療反応が得られない場合、ミノサイクリン、チゲサイクリン、レボフロキサシンのいずれかを追加し(最も好ましいのはミノサイクリン)併用する治療を推奨されている。なお、セフタジジムは、内因性にβ-ラクタマーゼを有していることから、重症度を問わず治療に用いるべきではないとされている41。なお、CLSI及びEUCASTはS. maltophiliaのコリスチン・チゲサイクリンに対する感受性判定のブレイクポイント149(薬剤感受性検査結果から、抗菌薬の治療効果を予測するために使用する基準値)を定めていない142。
表12. Stenotrophomonas maltophiliaに対する抗菌薬の主な選択肢41
| 薬剤名 | 投与法 |
|---|---|
| ST合剤(点滴) | AmpC産生腸内細菌目細菌の項参照 |
| レボフロキサシン | AmpC産生腸内細菌目細菌の項参照¶ |
| ミノサイクリン | Acinetobacter属の項参照 |
| チゲサイクリン | CREの項参照¶ |
表13. Stenotrophomonas maltophiliaに対する治療薬の推奨例(詳細は本文並びに補遺p.27-28参照)
| 推奨薬(各薬剤への感受性を確認) | 軽症 | 中等症・重症 |
|---|---|---|
| 第一推奨薬 | ST合剤、ミノサイクリン | ST合剤 + ミノサイクリン |
| 代替治療薬 | チゲサイクリン、レボフロキサシン | ST合剤 + チゲサイクリン or レボフロキサシン |
(6)クロストリジオイデス・ディフィシル(Clostridioides difficile)
疫学の概要と臨床的特徴
Clostridioides difficile(以下C. difficile)は、偏性嫌気性の芽胞形成性のグラム陽性桿菌であり、院内下痢症等を起こしうるC. difficile 感染症(C. difficile infection: CDI)の原因菌である。また、下痢症以外に重症例ではイレウスや中毒性巨大結腸症を起こしうることが知られている。さらに、芽胞を形成することで熱、放射線、乾燥、高圧処理、薬剤等に抵抗性を示すことが知られており、病院感染対策上重要な菌である。病態として、C. difficileが産生するトキシンAやトキシンBが発症に関与することが知られており、トキシンA/Bを産生しないC. difficileはCDIを発症しないことが知られている。
米国の報告では、病院で検出された菌として最も頻度が高いことが報告されたこともある150。2020年に報告されたシステマティックレビュー&メタアナリシスでは、院内発症のCDIは、8.3件/10,000患者日数であると報告されている151。日本で行われた多施設の前向き研究では、7.4件/10,000患者日数であった。欧米同様の頻度であり、日本でも重要な感染症である152。CDI発症者の約95%には外来、入院等の医療機関や介護施設を利用した経歴があり医療関連感染症としての側面が強い153。
24時間以内に3回以上の下痢(Bristol Stool Scaleで5以上:半固形のやわらかい便、不定形の泥状便、固形物を含まない液体状の便)を認める時や平常時よりも多い便回数の時にCDIを想起する必要がある154。
なお、国内ガイドライン(Clostridioides difficile感染症診療ガイドライン 2022)では排便が自立していない高齢者等では回数に固執する必要はないと推奨している155。院内で新規の下痢を見た時には、まずは検査を考慮する。頻度は低いが、下痢を認めずイレウスや中毒性巨大結腸症を来すことがあるため、入院中で上記を認めた時にはCDIを想起すべきである。過去3か月以内の抗菌薬曝露がリスクになることが報告されており156、外来での下痢症でも過去の抗菌薬曝露がある時には鑑別として上げる。また、1回の抗菌薬投与でもCDIは起こりうることが知られている157。
それ以外のリスクとして、年齢、胃酸抑制薬(プロトンポンプ阻害薬[proton pump inhibitor: PPI]、H2受容体拮抗薬を含む)の使用、最近の入院が報告されており、入院中の患者ではいずれも頻度の高いリスク因子である158。
微生物学的診断
トキシンとGDH抗原を同時に検出するキット、核酸増幅検査(Nucleic Acid Amplification Test: NAAT)又は便培養が国内では利用可能である。GDH(グルタミン酸脱水素酵素)抗原陽性はC. difficileの存在を示唆する。施設によって利用可能なものが異なるが、トキシンとGDHを同時検出できるキットをベースにトキシン陰性・GDH陽性の時にはNAAT又は便培養を行うアルゴリズムが提唱されている155,159。
なお、下痢、イレウスや中毒性巨大結腸症がない患者に検査を行わない。特にNAAT検査の過剰使用により偽陽性となり過剰な治療がされていることが指摘されている160。また、繰り返し検査は行わない(但し1週間経過しても可能性が残る時は再検も考慮される)。また、治療後の検査は推奨されないため、転院時等に治療後の患者に検査を求めないことを推奨する。
CDIは再発することが特徴的な感染症である。再発性CDIは、CDI発症後8週間以内にCDIを再度発症したものと定義されている155,159,161。適切な治療後でも30%程度が再発することが報告されており、初感染後の再発は10-20%、再発例の再発(再々発)は40-65%に及ぶ162-165。以下のようなリスクの例があげられている155:高齢(65歳以上)、抗菌薬の使用、重篤な基礎疾患の存在、CDIの既往、PPIの使用、医療関連CDI(発症前3か月以内の入院歴)。
治療方針
まずは、使用中の抗菌薬があれば、終了可能なものは終了する。
治癒率ではフィダキソマイシンとバンコマイシンの差はないが、再発率でみるとフィダキソマイシンの方が低い166。但し、コストの面の違いも大きく再発か否かや重症度を元に治療選択をする必要がある166,167。国内ガイドラインでは2回以上の再発例を難治例と定義している(標準治療期間終了後も下痢が改善しない例も難治例と定義される)155。
表14. CDIの重症度の評価例155,159,161
| ガイドライン | 重症 | 劇症 |
|---|---|---|
| IDSA/米国病院疫学学会 |
WBC>15,000 cells/mL、又は、 血清Cre≥1.5 mg/dL |
血圧低下、ショック、 イレウス又は中毒性巨大結腸症 |
| ヨーロッパ感染症学会 |
WBC>15,000 cells/mL又は 血清Creがベースラインより>50%、 又は、体温>38.5度の時 |
血圧低下、ショック、乳酸値の上昇、イレウス、 中毒性巨大結腸症、消化管穿孔 |
| 日本感染症学会 | 明確な基準の記載なし | |
表15. CDIの治療例155,159,161
| 薬剤 |
1回投与量 (記載ないものは経口投与) |
投与間隔 | 投与期間 |
|---|---|---|---|
| 非重症・非劇症例(初回) | |||
| フィダキソマイシン | 200 mg | 12時間毎 | 10日間 |
| バンコマイシン | 125 mg | 6時間毎 | 10日間 |
| メトロニダゾール | 500 mg | 8時間毎 | 10日間 |
| 非重症・非劇症例(初回再発) | |||
| フィダキソマイシン | 初回と同じ | ||
| バンコマイシン | 初回と同じ | ||
| バンコマイシン | パルス・漸減療法(補遺p.29-30参照) | ||
| 非重症・非劇症例(再々発、難治例) | |||
| フィダキソマイシン | 初回と同じ | ||
| バンコマイシン | パルス・漸減療法(補遺p.29-30参照 | ||
| 重症例 | |||
| バンコマイシン | 初回と同じ | ||
| バンコマイシン | 初回と同じ | ||
| 劇症例 | |||
|
バンコマイシン+ メトロニダゾール |
経口投与1回500 mg 6時間毎+点滴静注1回500 mg 8時間毎(20分以上かけて点滴静注) 10-14日間 | ||
| フィダキソマイシン | 初回と同じ | ||
※留意点を含む詳細は補遺p.29-30参照
外科的治療としての大腸全摘やDiverting loop ileostomy(迂回ループ回腸瘻造設術)の適応については、経験のある外科医や感染症専門医に相談が望ましい。再発例に関する糞便移植については、高い再発予防効果を有することが知られているが、日本では保険診療は適応されていない。また、重篤な有害事象の報告もあるため、考慮する場合には、感染症専門医に相談が望ましい。プロバイオティクスについてはCDIの発症・再発予防としての使用やCDIの治療時の併用薬としての十分なエビデンスはなく、積極的な使用は推奨されない。患者背景によってはプロバイオティクスによる菌血症を起こすことがあり、使用する際も適応を吟味する必要がある168。抗菌薬の終了が困難な時のCDIの治療については補遺p.29-30参照に記した。
(7) カンジダ
疫学の概要と臨床的特徴
侵襲性真菌感染症の約70-90%はカンジダ感染症が占め、カンジダ血症や深在性カンジダ症あるいはいずれも認める侵襲性カンジダ症の死亡率は40-60%と不良である169,170。侵襲性カンジダ症の主な侵入門戸は、皮膚や血管内カテーテル、消化管である169。
カンジダの主要5菌種はCandida albicans、Candida glabrata、Candida tropicalis、Candida parapsilosis、Candida kruseiで、C. glabrataとC. kruseiのアゾール耐性、C. parapsilosisのキャンディン自然耐性やバイオフィルム形成によるCRBSIが問題となっている169,171,172。
国内で2009年に初めて耳道検体から検出されたCandida aurisは、その後世界各地で検出されるようになり、アゾール耐性だけでなくポリエンへの耐性も問題となっている173。
侵襲性カンジダ症のリスク因子は、広域抗菌薬使用、中心静脈カテーテル、中心静脈栄養、腹部外科術後、APACHEIIスコア高値、悪性腫瘍、好中球減少、化学療法、移植後、急性腎障害、血液透析、糖尿病、長期入院やICU入室、未熟児・低出生体重等である171,172。
微生物学的診断
スクリーニング検査としては血中β-D-グルカン(感度65-85%、特異度75-85%)174,175、確定診断には血液培養(感度~50%、特異度不明)169がある。現在国内で使用可能なβ-D-グルカンの測定キットには複数のものがあるが、それぞれにカットオフ値が異なる点に留意する。陰性的中率は高い一方、抗菌薬やアルブミン投与下で偽陽性になることに留意する176。血液培養は陽性化までに2-3日間必要で陽性率も低いことに留意する169,171,172。
2023年2月現在、国内では保険収載されていないが、全血PCR(T2 Candida panel)が米国等で用いられており、その感度と特異度はそれぞれ91%と94%である169,171,172。カンジダスコアは侵襲性カンジダ症を予測するスクリーニング検査で、①中心静脈栄養(1点)、②手術(1点)、③複数部位でのコロニゼーション(1点)、④敗血症(2点)の4項目(計5点)中のうち3点以上で侵襲性カンジダ症発症を予測する(感度81%、特異度74%)177。
治療方針
治療は大きく抗真菌薬治療と感染巣コントロール(血管内カテーテルや人工物の抜去、外科的ドレナージやデブリドマン)に分けられ、前者はさらに目的別で以下へ分類される171。
- 予防的治療:無症状で造血幹細胞や臓器移植後の持続する好中球減少症例に実施
- 経験的治療:有症状でICUに96時間以上滞在し、広域抗菌薬投与中で中心静脈栄養もしくは消化管手術もしくは敗血症がある症例に実施
- 先制治療:経験的治療で挙げられた条件に加えてβ-D-グルカン陽性あるいは複数部位でのコロニゼーションが確認された症例に実施
- 標的治療:無菌部位から培養が検出された症例に対して実施
侵襲性カンジダ症に対しては、殺菌性作用を示すエキノキャンディン系(ミカファンギン、カスポファンギン)かポリエン系(アムホテリシンB、アムホテリシンBリポソーム製剤)が第一選択であり171,178,179、一般的には薬剤の副作用や耐性が比較的少ないエキノキャンディン系抗真菌薬を選択することが多い。C. parapsilosisに対しては薬剤感受性結果に基づき、アゾール系やエキノキャンディン系を選択する。C. glabrataとC. kruseiに対してはエキノキャンディン系抗真菌薬を選択する179。侵襲性カンジダ症に対するエキノキャンディン系、ポリエン系、アゾール系抗真菌薬の効果を比較したメタアナリシスでは、エキノキャンディン系抗真菌薬が最も治療成功率が高かったが、生存率の有意差は見られなかった180。抗真菌薬の分類(表16)と投与量(表17)は以下に示した。
カンジダ菌血症を認めた場合は、早期に眼内炎を評価するための眼底検査(7日以内)と感染性心内膜炎を除外するための心エコー検査(できれば24時間以内)を実施する178,179。治療開始から5-7日間経過しカンジダ菌血症消失を確認し、全身状態が安定しており薬剤感受性が良好であれば、エキノキャンディン系やポリエン系からアゾール系抗真菌薬への狭域化を検討する178,179。
抗真菌薬の一般的な投与期間は、感染転移巣や好中球減少のないカンジダ菌血症では陰性化が確認されるまで毎日(あるいは隔日)血液培養を繰り返し、培養陰性化と症状消失から14日間、カンジダ感染性心内膜炎で手術後最低6週間(手術不可能な場合は長期間)、カンジダ腹腔内感染症では感染巣がコントロールされ症状消失するまで、カンジダ眼内炎では最低4-6週間、カンジダ複雑性尿路感染では14日間である178,179。
感染症科へのコンサルテーションはカンジダ血症の30日予後で独立した改善因子であり、可能な施設では積極的に感染症専門医へのコンサルテーションを考慮する181。
表16. 抗真菌薬の分類
| エキノキャンディン系 | ポリエンマクロライド系 | アゾール系 | |
|---|---|---|---|
| 主な薬剤 |
ミカファンギン カスポファンギン |
アムホテリシンB 上記のリポソーム製剤 |
フルコナゾール |
| 作用 | 殺菌性 | 殺菌性 | 静菌性 |
| 機序 | 細胞壁合成阻害 | 細胞膜破壊 | 細胞膜合成阻害 |
| 注意点 |
眼・尿路・中枢神経へ浸透しにくい 点滴のみ |
肝・腎障害 電解質異常 発熱 |
肝障害 薬剤相互作用多い 催奇形性 |
表17. 各抗真菌薬の投与量
| 薬剤名 | 初期投与量 | 維持投与量(日) | 付記 |
|---|---|---|---|
| ミカファンギン | – |
点滴静注1回100 mg 24時間毎 1時間以上かけて |
重症例では、1回150 mgまでの増量を検討 |
| カスポファンギン |
初日1回70 mg 24時間毎 約1時間かけて点滴静注 |
点滴静注1回50 mg 24時間毎 約1時間かけて |
肝障害(Child-Pugh 7-9)では35 mg/日へ減量 |
|
アムホテリシンB リポソーム製剤 |
– |
点滴静注1回2.5-5 mg/kg 24時間毎 1-2時間以上かけて |
– |
| フルコナゾール | – |
静注1回400 mg 24時間毎 |
CCr < 50で維持量を50%へ減量 内服及び腸管吸収が可能な場合は、 同量のまま点滴から内服へ変更を検討 |
表18. 眼内炎を伴わない侵襲性カンジダ治療薬の推奨例179
| 推奨薬(各薬剤への感受性を確認) | |||
|---|---|---|---|
| <経験的治療> | <標的治療> | ||
| C. albicans | C. glabrata, C. krusei | C. parapsilosis | |
|
ミカファンギン、 カスポファンギン |
フルコナゾール |
ミカファンギン、 カスポファンギン |
薬剤感受性に基づき フルコナゾール、 ミカファンギン、 カスポファンギンより選択 |
2. 引用文献
- GBD 2019 Antimicrobial Resistance Collaborators. Global mortality associated with 33 bacterial pathogens in 2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet. 2022 Dec;400(10369):2221-2248.
- Bennett JE, Dolin R, Blaser MJ. Mandell, Douglas, and Bennett's Principles and Practice of Infectious Diseases. 9th ed. Philadelphia: Elsevier 2019.
- Pien BC, Sundaram P, Raoof N. et al. The clinical and prognostic importance of positive blood cultures in adults. Am J Med. 2010 Sep;123(9):819-828.
- Thwaites GE, Edgeworth JD, Gkrania-Klotsas E. et al. Clinical management of Staphylococcus aureus bacteraemia. Lancet Infect Dis 2011 Mar;11(3):208-222.
- Bai AD, Morris AM. Management of Staphylococcus aureus bacteremia in adults. CMAJ. 2019 Sep;191(135):E967.
- Bai AD, Agarwal A, Steinberg M. et al. Clinical predictors and clinical prediction rules to estimate initial patient risk for infective endocarditis in Staphylococcus aureus bacteraemia: a systematic review and meta-analysis. Clin Microbiol Infect. 2017 Dec;23(12):900-906.
- Government of South Australia. Staphylococcus aureus Bacteraemia Management Clinical Guideline. Version 2.0. 2023.
- Coburn B, Morris AM, Tomlinson G, Detsky AS. Does this adult patient with suspected bacteremia require blood cultures? JAMA 2012;308:502-511.
- Lam JC, Stokes W. The Golden Grapes of Wrath - Staphylococcus aureus Bacteremia: A Clinical Review. Am J Med. 2023 Jan;136(1):19-26.
- Li J, Echevarria KL, Hughes DW, Cadena JA, Bowling JE, Lewis JS, 2nd. Comparison of cefazolin versus oxacillin for treatment of complicated bacteremia caused by methicillin-susceptible Staphylococcus aureus. Antimicrob Agents Chemother. 2014 Sep;58(9):5117-5124.
- 抗菌薬 TDM 臨床実践ガイドライン 公益社団法人日本化学療法学会/一般社団法人日本 TDM 学会. 2022. at https://www.chemotherapy.or.jp/uploads/files/guideline/tdm2022.pdf.)
- Liu C, Bayer A, Cosgrove SE. et al. Clinical practice guidelines by the infectious diseases society of america for the treatment of methicillin-resistant Staphylococcus aureus infections in adults and children. Clin Infect Dis 2011 Feb;52(3):e18-55.
- Figueroa DA, Mangini E, Amodio-Groton M. et al. Safety of high-dose intravenous daptomycin treatment: three-year cumulative experience in a clinical program. Clin Infect Dis 2009 Jul;49(2):177-180.
- 厚生労働省 バンコマイシン耐性腸球菌感染症. at https://www.mhlw.go.jp/bunya/kenkou/kekkaku-kansenshou11/01-05-14-01.html.)
- 国立感染症研究所 発生動向調査年別一覧(全数把握). at https://www.niid.go.jp/niid/ja/ydata/11530-report-ja2021-30.html.)
- Cetinkaya Y, Falk P, Mayhall CG. Vancomycin-resistant enterococci. Clin Microbiol Rev 2000;13:686-707.
- Prematunge C, MacDougall C, Johnstone J. et al. VRE and VSE Bacteremia Outcomes in the Era of Effective VRE Therapy: A Systematic Review and Meta-analysis. Infect Control Hosp Epidemiol. 2016;37:26-35.
- Hayakawa K, Mezaki K, Sugiki Y. et al. High rate of multidrug-resistant organism colonization among patients hospitalized overseas highlights the need for preemptive infection control. Am J Infect Control. 2016 Nov;44(11):e257-e259.
- 日本化学療法学会 抗菌化学療法認定医認定制度審議委員会 抗菌薬適正使用生涯教育テキスト 第3版2020.
- Wurpts G, Aberer W, Dickel H. et al. Guideline on diagnostic procedures for suspected hypersensitivity to beta-lactam antibiotics: Guideline of the German Society for Allergology and Clinical Immunology (DGAKI) in collaboration with the German Society of Allergology (AeDA), German Society for Pediatric Allergology and Environmental Medicine (GPA), the German Contact Dermatitis Research Group (DKG), the Austrian Society for Allergology and Immunology (OGAI), and the Paul-Ehrlich Society for Chemotherapy (PEG). Allergol Select. 2020 May;4:11-43.
- Baddour LM, Wilson WR, Bayer AS. et al. Infective Endocarditis in Adults: Diagnosis, Antimicrobial Therapy, and Management of Complications: A Scientific Statement for Healthcare Professionals From the American Heart Association. Circulation. 2015 Oct;132(15):1435-1486.
- Britt NS, Potter EM, Patel N, Steed ME. Comparison of the Effectiveness and Safety of Linezolid and Daptomycin in Vancomycin-Resistant Enterococcal Bloodstream Infection: A National Cohort Study of Veterans Affairs Patients. Clin Infect Dis. 2015 Sep;61(6):871-878.
- Adeolu M, Alnajar S, Naushad S, Gupta RS. Genome-based phylogeny and taxonomy of the 'Enterobacteriales': proposal for Enterobacterales ord. nov. divided into the families Enterobacteriaceae, Erwiniaceae fam. nov., Pectobacteriaceae fam. nov., Yersiniaceae fam. nov., Hafniaceae fam. nov., Morganellaceae fam. nov., and Budviciaceae fam. nov. Int J Syst Evol Microbiol. 2016 Dec;66(12):5575-5599.
- 原田壮平 薬剤耐性腸内細菌目細菌の基礎と疫学 Update 日本臨床微生物学会雑誌 Vol. 31 No. 4. 2021.
- Paterson DL, Bonomo RA. Extended-spectrum beta-lactamases: a clinical update. Clin Microbiol Rev. 2005 Oct;18(4):657-686.
- Castanheira M, Simner PJ, Bradford PA. Extended-spectrum beta-lactamases: an update on their characteristics, epidemiology and detection. JAC Antimicrob Resist. 2021 Jul;3(3):dlab092.
- JANIS公開情報 院内感染対策サーベイランス 検査部門 入院検体. 2021. at https://janis.mhlw.go.jp/report/open_report/2021/3/1/ken_Open_Report_202100.pdf.)
- JANIS公開情報 院内感染対策サーベイランス 検査部門 外来検体. 2021. at https://janis.mhlw.go.jp/report/open_report/2021/3/1/ken_Open_Report_202100_Outpatient.pdf.)
- Arcilla MS, van Hattem JM, Haverkate MR. et al. Import and spread of extended-spectrum beta-lactamase-producing Enterobacteriaceae by international travellers (COMBAT study): a prospective, multicentre cohort study. Lancet Infect Dis. 2017 Jan;17(1):78-85.
- Rodriguez-Bano J, Picon E, Gijon P. et al. Community-onset bacteremia due to extended-spectrum beta-lactamase-producing Escherichia coli: risk factors and prognosis. Clin Infect Dis. 2010 Jan;50(1):40-48.
- Goodman KE, Lessler J, Cosgrove SE. et al. A Clinical Decision Tree to Predict Whether a Bacteremic Patient Is Infected With an Extended-Spectrum beta-Lactamase-Producing Organism. Clin Infect Dis. 2016 Oct;63(7):896-903.
- CSLI M100-32nd Edition. at http://em100.edaptivedocs.net/dashboard.aspx,.)
- 一般社団法人日本臨床微生物学会 多剤耐性菌検査の手引き. 2021. at https://www.jscm.org/modules/guideline/index.php?content_id=15.)
- Nicolle LE, Gupta K, Bradley SF. et al. Clinical Practice Guideline for the Management of Asymptomatic Bacteriuria: 2019 Update by the Infectious Diseases Society of America. Clin Infect Dis. 2019 May;68(10):e83-e110.
- Armand-Lefevre L, Angebault C, Barbier F. et al. Emergence of imipenem-resistant gram-negative bacilli in intestinal flora of intensive care patients. Antimicrob Agents Chemother. 2013 Mar;57(3):1488-1495.
- Ishikawa K, Uehara Y, Mori N. et al. In Vitro Activity and Clinical Efficacy of Faropenem against Third-Generation Cephalosporin-Resistant Escherichia coli and Klebsiella pneumoniae. Antimicrob Agents Chemother. 2022 Jun;66(6):e0012522.
- Eckburg PB, Muir L, Critchley IA. et al. Oral Tebipenem Pivoxil Hydrobromide in Complicated Urinary Tract Infection. N Engl J Med. 2022 Apr;386(14):1327-1338.
- Hamada Y, Kasai H, Suzuki-Ito M, Matsumura Y, Doi Y, Hayakawa K. Pharmacokinetic/Pharmacodynamic Analysis and Dose Optimization of Cefmetazole and Flomoxef against Extended-Spectrum beta-Lactamase-Producing Enterobacterales in Patients with Invasive Urinary Tract Infection Considering Renal Function. Antibiotics (Basel). 2022 Mar;11(4):456.
- Hayakawa K, Matsumura Y, Uemura K. et al. Effectiveness of cefmetazole versus meropenem for invasive urinary tract infections caused by extended-spectrum beta-lactamase-producing Escherichia coli. Antimicrob Agents Chemother 2023 Oct;67(10):e0051023.
- JAID/JSC感染症治療ガイド・ガイドライン作成委員会 JAID/JSC感染症治療ガイド2019. ライフサイエンス出版;2019
- Tamma PD, Aitken SL, Bonomo RA, Mathers AJ, van Duin D, Clancy CJ. Infectious Diseases Society of America 2023 Guidance on the Treatment of Antimicrobial Resistant Gram-Negative Infections. Clin Infect Dis. 2023 Jul:ciad428.
- Rodriguez-Bano J, Alcala JC, Cisneros JM. et al. Community infections caused by extended-spectrum beta-lactamase-producing Escherichia coli. Arch Intern Med. 2008 Sep;168(17):1897-1902.
- Lo CL, Lee CC, Li CW. et al. Fluoroquinolone therapy for bloodstream infections caused by extended-spectrum beta-lactamase-producing Escherichia coli and Klebsiella pneumoniae. J Microbiol Immunol Infect. 2017 Jun;50(3):355-61.
- Punjabi C, Tien V, Meng L, Deresinski S, Holubar M. Oral Fluoroquinolone or Trimethoprim-sulfamethoxazole vs. ss-lactams as Step-Down Therapy for Enterobacteriaceae Bacteremia: Systematic Review and Meta-analysis. Open Forum Infect Dis. 2019 Aug;6(10):ofz364.
- Tamma PD, Doi Y, Bonomo RA, Johnson JK, Simner PJ, Antibacterial Resistance Leadership G. A Primer on AmpC beta-Lactamases: Necessary Knowledge for an Increasingly Multidrug-resistant World. Clin Infect Dis. 2019 Sep;69(8):1446-1455.
- 西村翔. よくわかっているようでよくわかっていないAmpCのハナシ(1) J-IDEO Vol.1 No.3. 2017:343-350.
- Kohlmann R, Bahr T, Gatermann SG. Species-specific mutation rates for ampC derepression in Enterobacterales with chromosomally encoded inducible AmpC beta-lactamase. J Antimicrob Chemother. 2018 Jun;73(6):1530-1536.
- Tamma PD, Girdwood SC, Gopaul R. et al. The use of cefepime for treating AmpC beta-lactamase-producing Enterobacteriaceae. Clin Infect Dis. 2013 Sep;57(6):781-788.
- Stewart AG, Paterson DL, Young B. et al. Meropenem Versus Piperacillin-Tazobactam for Definitive Treatment of Bloodstream Infections Caused by AmpC beta-Lactamase-Producing Enterobacter spp, Citrobacter freundii, Morganella morganii, Providencia spp, or Serratia marcescens: A Pilot Multicenter Randomized Controlled Trial (MERINO-2). Open Forum Infect Dis. 2021 Aug;8(8):ofab387.
- Chaubey VP, Pitout JD, Dalton B, Gregson DB, Ross T, Laupland KB. Clinical and microbiological characteristics of bloodstream infections due to AmpC beta-lactamase producing Enterobacteriaceae: an active surveillance cohort in a large centralized Canadian region. BMC Infect Dis. 2014 Dec;14:647.
- Cheng L, Nelson BC, Mehta M. et al. Piperacillin-Tazobactam versus Other Antibacterial Agents for Treatment of Bloodstream Infections Due to AmpC beta-Lactamase-Producing Enterobacteriaceae. Antimicrob Agents Chemother. 2017 May;61(6):e00276-17.
- Meije Y, Pigrau C, Fernandez-Hidalgo N. et al. Non-intravenous carbapenem-sparing antibiotics for definitive treatment of bacteraemia due to Enterobacteriaceae producing extended-spectrum beta-lactamase (ESBL) or AmpC beta-lactamase: A propensity score study. Int J Antimicrob Agents. 2019 Aug;54(2):189-196.
- Maan G, Keitoku K, Kimura N. et al. Cefepime-induced neurotoxicity: systematic review. J Antimicrob Chemother 2022 Oct;77(11):2908-2921.
- Kunz Coyne AJ, El Ghali A, Lucas K, et al. High-dose Cefepime vs Carbapenems for Bacteremia Caused by Enterobacterales With Moderate to High Risk of Clinically Significant AmpC beta-lactamase Production. Open Forum Infect Dis. 2023 Jan;10(3):ofad034.
- Tamma PD, Conley AT, Cosgrove SE. et al. Association of 30-Day Mortality With Oral Step-Down vs Continued Intravenous Therapy in Patients Hospitalized With Enterobacteriaceae Bacteremia. JAMA Intern Med. 2019 Mar;179(3):316-323.
- 厚生労働省 カルバペネム耐性腸内細菌科細菌感染症. at https://www.mhlw.go.jp/bunya/kenkou/kekkaku-kansenshou11/01-05-140912-1.html.)
- 国立感染症研究所 カルバペネム耐性腸内細菌目細菌(carbapenem-resistant Enterobacterales: CRE)病原体サーベイランス, 2021年 IASR Vol. 44 p130-131: 2023年8月号. 2023. at https://www.niid.go.jp/niid/ja/cre-m/cre-iasrd/12223-522d03.htmljh.)
- Oka K, Matsumoto A, Tetsuka N. et al. Clinical characteristics and treatment outcomes of carbapenem-resistant Enterobacterales infections in Japan. J Glob Antimicrob Resist. 2022 Jun;29:247-252.
- van Loon K, Voor In 't Holt AF, Vos MC. A Systematic Review and Meta-analyses of the Clinical Epidemiology of Carbapenem-Resistant Enterobacteriaceae. Antimicrob Agents Chemother. 2017 Dec;62(1):e01730-17.
- 西村翔. 混同しがちなCREとCPEのハナシ(2) J-IDEO Vol.3 No.3. 2019:346-55.
- Shigemoto N, Kuwahara R, Kayama S. et al. Emergence in Japan of an imipenem-susceptible, meropenem-resistant Klebsiella pneumoniae carrying blaIMP-6. Diagn Microbiol Infect Dis. 2012 Jan;72(1):109-112.
- Yano H, Ogawa M, Endo S. et al. High frequency of IMP-6 among clinical isolates of metallo-beta-lactamase-producing Escherichia coli in Japan. Antimicrob Agents Chemother. 2012 Aug;56(8):4554-4555.
- EUCAST guideline for the detection of resistance mechanisms and specific resistances of clinical and/or epidemiological importance, v2. 2017. at https://www.eucast.org/resistance_mechanisms.)
- 西村翔. CREの治療(4) J-IDEO Vol.4 No.4. 2020:99-105.
- Perez F, El Chakhtoura NG, Yasmin M, Bonomo RA. Polymyxins: To Combine or Not to Combine? Antibiotics (Basel). 2019 Apr;8(2):38.
- Paul M, Carrara E, Retamar P. et al. European Society of Clinical Microbiology and Infectious Diseases (ESCMID) guidelines for the treatment of infections caused by multidrug-resistant Gram-negative bacilli (endorsed by European society of intensive care medicine). Clin Microbiol Infect. 2022 Apr;28(4):521-547.
- Hayakawa K, Nakano R, Hase R. et al. Comparison between IMP carbapenemase-producing Enterobacteriaceae and non-carbapenemase-producing Enterobacteriaceae: a multicentre prospective study of the clinical and molecular epidemiology of carbapenem-resistant Enterobacteriaceae. J Antimicrob Chemother. 2020 Mar;75(3):697-708.
- van Duin D, Arias CA, Komarow L. et al. Molecular and clinical epidemiology of carbapenem-resistant Enterobacterales in the USA (CRACKLE-2): a prospective cohort study. Lancet Infect Dis. 2020 Jun;20(6):731-741.
- Saito S, Hayakawa K, Tsuzuki S. et al. A Matched Case-Case-Control Study of the Impact of Clinical Outcomes and Risk Factors of Patients with IMP-Type Carbapenemase-Producing Carbapenem-Resistant Enterobacteriaceae in Japan. Antimicrob Agents Chemother. 2021 Feb;65(3):e01483-20.
- Senchyna F, Gaur RL, Sandlund J. et al. Diversity of resistance mechanisms in carbapenem-resistant Enterobacteriaceae at a health care system in Northern California, from 2013 to 2016. Diagn Microbiol Infect Dis. 2019 Mar;93(3):250-257.
- Bonnin RA, Bernabeu S, Emeraud C. et al. In Vitro Activity of Imipenem-Relebactam, Meropenem-Vaborbactam, Ceftazidime-Avibactam and Comparators on Carbapenem-Resistant Non-Carbapenemase-Producing Enterobacterales. Antibiotics (Basel). 2023 Jan;12(1):102.
- Tamma PD, Bergman Y, Jacobs EB. et al. Comparing the activity of novel antibiotic agents against carbapenem-resistant Enterobacterales clinical isolates. Infect Control Hosp Epidemiol. 2023 May;44(5):762-767.
- Tsuji BT, Pogue JM, Zavascki AP, et al. International Consensus Guidelines for the Optimal Use of the Polymyxins: Endorsed by the American College of Clinical Pharmacy (ACCP), European Society of Clinical Microbiology and Infectious Diseases (ESCMID), Infectious Diseases Society of America (IDSA), International Society for Anti-infective Pharmacology (ISAP), Society of Critical Care Medicine (SCCM), and Society of Infectious Diseases Pharmacists (SIDP). Pharmacotherapy 2019;39:10-39.
- Zha L, Pan L, Guo J, French N, Villanueva EV, Tefsen B. Effectiveness and Safety of High Dose Tigecycline for the Treatment of Severe Infections: A Systematic Review and Meta-Analysis. Adv Ther 2020 Mar;37(3):1049-1064.
- De Pascale G, Lisi L, Ciotti GMP. et al. Pharmacokinetics of high-dose tigecycline in critically ill patients with severe infections. Ann Intensive Care. 2020 Jul;10(1):94.
- Paul M, Daikos GL, Durante-Mangoni E. et al. Colistin alone versus colistin plus meropenem for treatment of severe infections caused by carbapenem-resistant Gram-negative bacteria: an open-label, randomised controlled trial. Lancet Infect Dis. 2018 Apr;18(4):391-400.
- Pascale R, Giannella M, Bartoletti M, Viale P, Pea F. Use of meropenem in treating carbapenem-resistant Enterobacteriaceae infections. Expert Rev Anti Infect Ther. 2019 Oct;17(10):819-827.
- コリスチンの適正使用に関する指針―改訂版―, 日本化学療法学会雑誌;63(3):290-329. 2015. at https://www.chemotherapy.or.jp/uploads/files/guideline/colistin_guideline_update.pdf.)
- チゲサイクリン適正使用のための手引き 日本化学療法学会雑誌; 62(3):311-366. 2014;62:311-66.
- Tamma PD, Han JH, Rock C. et al. Carbapenem therapy is associated with improved survival compared with piperacillin-tazobactam for patients with extended-spectrum beta-lactamase bacteremia. Clin Infect Dis. 2015 May;60(9):1319-1325.
- NICE Guideline. Sepsis: recognition, diagnosis and early management. 2017. at https://www.nice.org.uk/guidance/ng51/resources/sepsis-recognition-diagnosis-and-early-management-pdf-1837508256709.)
- Heil EL, Bork JT, Abbo LM. et al. Optimizing the Management of Uncomplicated Gram-Negative Bloodstream Infections: Consensus Guidance Using a Modified Delphi Process. Open Forum Infect Dis. 2021 Oct;8(10):ofab434.
- Poutsiaka DD, Davidson LE, Kahn KL, Bates DW, Snydman DR, Hibberd PL. Risk factors for death after sepsis in patients immunosuppressed before the onset of sepsis. Scand J Infect Dis. 2009;41(6-7):469-479.
- Evans L, Rhodes A, Alhazzani W. et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock 2021. Intensive Care Med. 2021 Nov;47(11):1181-1247.
- 厚生労働省 薬剤耐性緑膿菌感染症. at https://www.mhlw.go.jp/bunya/kenkou/kekkaku-kansenshou11/01-05-42-01.html.)
- Kadri SS, Adjemian J, Lai YL. et al. Difficult-to-Treat Resistance in Gram-negative Bacteremia at 173 US Hospitals: Retrospective Cohort Analysis of Prevalence, Predictors, and Outcome of Resistance to All First-line Agents. Clin Infect Dis. 2018 Nov;67(12):1803-1814.
- Mano Y, Saga T, Ishii Y. et al. Molecular analysis of the integrons of metallo-beta-lactamase-producing Pseudomonas aeruginosa isolates collected by nationwide surveillance programs across Japan. BMC Microbiol. 2015 Feb;15:41.
- Nakayama R, Inoue-Tsuda M, Matsui H, Ito T, Hanaki H. Classification of the metallo beta-lactamase subtype produced by the carbapenem-resistant Pseudomonas aeruginosa isolates in Japan. J Infect Chemother. 2022 Feb;28(2):170-175.
- Uechi K, Tada T, Shimada K. et al. A Modified Carbapenem Inactivation Method, CIMTris, for Carbapenemase Production in Acinetobacter and Pseudomonas Species. J Clin Microbiol. 2017 Dec;55(12):3405-3410.
- 西村翔. CREの治療 (5) J-IDEO Vol.4 No.5. 2020.
- Pogue JM, Kaye KS, Veve MP. et al. Ceftolozane/Tazobactam vs Polymyxin or Aminoglycoside-based Regimens for the Treatment of Drug-resistant Pseudomonas aeruginosa. Clin Infect Dis. 2020 Jul;71(2):304-310.
- Motsch J, Murta de Oliveira C, Stus V. et al. RESTORE-IMI 1: A Multicenter, Randomized, Double-blind Trial Comparing Efficacy and Safety of Imipenem/Relebactam vs Colistin Plus Imipenem in Patients With Imipenem-nonsusceptible Bacterial Infections. Clin Infect Dis. 2020 Apr;70(9):1799-1808.
- Karlowsky JA, Lob SH, Raddatz J. et al. In Vitro Activity of Imipenem/Relebactam and Ceftolozane/Tazobactam Against Clinical Isolates of Gram-negative Bacilli With Difficult-to-Treat Resistance and Multidrug-resistant Phenotypes-Study for Monitoring Antimicrobial Resistance Trends, United States 2015-2017. Clin Infect Dis. 2021 Jun;72(12):2112-2120.
- 西村翔. 誰も教えてくれないザバクサの使いドコロ J-IDEO Vol.3 No.4. 2019:82-
- Karlowsky JA, Lob SH, DeRyke CA. et al. In Vitro Activity of Ceftolozane-Tazobactam, Imipenem-Relebactam, Ceftazidime-Avibactam, and Comparators against Pseudomonas aeruginosa Isolates Collected in United States Hospitals According to Results from the SMART Surveillance Program, 2018 to 2020. Antimicrob Agents Chemother. 2022 May;66(5):e0018922.
- Hart DE, Gallagher JC, Puzniak LA, Hirsch EB, C/T Alliance to deliver Real-world Evidence (CARE). A Multicenter Evaluation of Ceftolozane/Tazobactam Treatment Outcomes in Immunocompromised Patients With Multidrug-Resistant Pseudomonas aeruginosa Infections. Open Forum Infect Dis. 2021 Mar;8(3):ofab089.
- Corbella L, Boan J, San-Juan R. et al. Effectiveness of ceftazidime-avibactam for the treatment of infections due to Pseudomonas aeruginosa. Int J Antimicrob Agents. 2022 Feb;59(2):106517.
- Stone GG, Newell P, Gasink LB. et al. Clinical activity of ceftazidime/avibactam against MDR Enterobacteriaceae and Pseudomonas aeruginosa: pooled data from the ceftazidime/avibactam Phase III clinical trial programme. J Antimicrob Chemother. 2018 Sep;73(9):2519-2523.
- Bassetti M, Echols R, Matsunaga Y. et al. Efficacy and safety of cefiderocol or best available therapy for the treatment of serious infections caused by carbapenem-resistant Gram-negative bacteria (CREDIBLE-CR): a randomised, open-label, multicentre, pathogen-focused, descriptive, phase 3 trial. Lancet Infect Dis. 2021 Feb;21(2):226-240.
- Satlin MJ, Simner PJ, Slover CM, Yamano Y, Nagata TD, Portsmouth S. Cefiderocol Treatment for Patients with Multidrug- and Carbapenem-Resistant Pseudomonas aeruginosa Infections in the Compassionate Use Program. Antimicrob Agents Chemother. 2023 Jul;67(7):e0019423.
- Timsit JF, Paul M, Shields RK. et al. Cefiderocol for the Treatment of Infections Due to Metallo-B-lactamase-Producing Pathogens in the CREDIBLE-CR and APEKS-NP Phase 3 Randomized Studies. Clin Infect Dis. 2022 Sep;75(6):1081-1084.
- Gill CM, Aktas E, Alfouzan W. et al. Elevated MICs of Susceptible Antipseudomonal Cephalosporins in Non-Carbapenemase-Producing, Carbapenem-Resistant Pseudomonas aeruginosa: Implications for Dose Optimization. Antimicrob Agents Chemother. 2021 Oct;65(11):e0120421.
- Bauer KA, West JE, O'Brien JM, Goff DA. Extended-infusion cefepime reduces mortality in patients with Pseudomonas aeruginosa infections. Antimicrob Agents Chemother. 2013 Jul;57(7):2907-2912.
- Lodise TP, Jr., Lomaestro B, Drusano GL. Piperacillin-tazobactam for Pseudomonas aeruginosa infection: clinical implications of an extended-infusion dosing strategy. Clin Infect Dis. 2007 Feb;44(3):357-363.
- Hong LT, Downes KJ, FakhriRavari A. et al. International consensus recommendations for the use of prolonged-infusion beta-lactam antibiotics: Endorsed by the American College of Clinical Pharmacy, British Society for Antimicrobial Chemotherapy, Cystic Fibrosis Foundation, European Society of Clinical Microbiology and Infectious Diseases, Infectious Diseases Society of America, Society of Critical Care Medicine, and Society of Infectious Diseases Pharmacists. Pharmacotherapy. 2023 Aug;43(8):740-777.
- Ramsey C, MacGowan AP. A review of the pharmacokinetics and pharmacodynamics of aztreonam. J Antimicrob Chemother. 2016 Oct;71(10):2704-2712.
- Moriyama B, Henning SA, Childs R. et al. High-dose continuous infusion beta-lactam antibiotics for the treatment of resistant Pseudomonas aeruginosa infections in immunocompromised patients. Ann Pharmacother. 2010 May;44(5):929-935.
- Vinks AA, van Rossem RN, Mathot RA, Heijerman HG, Mouton JW. Pharmacokinetics of aztreonam in healthy subjects and patients with cystic fibrosis and evaluation of dose-exposure relationships using monte carlo simulation. Antimicrob Agents Chemother. 2007 Sep;51(9):3049-3055.
- Peleg AY, Seifert H, Paterson DL. Acinetobacter baumannii: emergence of a successful pathogen. Clin Microbiol Rev. 2008 Jul;21(3):538-582.
- Wong D, Nielsen TB, Bonomo RA, Pantapalangkoor P, Luna B, Spellberg B. Clinical and Pathophysiological Overview of Acinetobacter Infections: a Century of Challenges. Clin Microbiol Rev. 2017 Jan;30(1):409-447.
- Karageorgopoulos DE, Falagas ME. Current control and treatment of multidrug-resistant Acinetobacter baumannii infections. Lancet Infect Dis. 2008 Dec;8(12):751-762.
- Falagas ME, Karveli EA, Kelesidis I, Kelesidis T. Community-acquired Acinetobacter infections. Eur J Clin Microbiol Infect Dis. 2007 Dec;26(12):857-868.
- Asai N, Sakanashi D, Suematsu H. et al. Clinical manifestations and risk factors of community-onset Acinetobacter species pneumonia in Japan; case control study in a single institute in Japan. J Infect Chemother. 2019 Aug;25(8):639-642.
- WHO priority pathogens list for R&D of new antibiotics. 2017. at https://www.who.int/news/item/27-02-2017-who-publishes-list-of-bacteria-for-which-new-antibiotics-are-urgently-needed.)
- 韓国からの持ち込み例を端緒とした多剤耐性Acinetobacter baumannii によるアウトブレイク事例 IASR Vol. 31 p. 197-198: 2010年7月号. 2010. at http://idsc.nih.go.jp/iasr/31/365/dj3654.html.)
- Tojo M, Mawatari M, Hayakawa K. et al. Multidrug-resistant Acinetobactor baumannii isolated from a traveler returned from Brunei. J Infect Chemother. 2015 Mar;21(3):212-214.
- 医療機関における海外からの高度薬剤耐性菌の持ち込み対策に関するガイダンス, DCC. 2019. at https://dcc.ncgm.go.jp/prevention/resource/resource05.pdf.)
- 厚生労働省 薬剤耐性アシネトバクター感染症. at https://www.mhlw.go.jp/bunya/kenkou/kekkaku-kansenshou11/01-05-140912-4.html.)
- Wisplinghoff H, Edmond MB, Pfaller MA, Jones RN, Wenzel RP, Seifert H. Nosocomial bloodstream infections caused by Acinetobacter species in United States hospitals: clinical features, molecular epidemiology, and antimicrobial susceptibility. Clin Infect Dis. 2000 Sep;31(7):690-697.
- Martin-Aspas A, Guerrero-Sanchez FM, Garcia-Colchero F, Rodriguez-Roca S, Giron-Gonzalez JA. Differential characteristics of Acinetobacter baumannii colonization and infection: risk factors, clinical picture, and mortality. Infect Drug Resist. 2018 Jun;11:861-872.
- Fishbain J, Peleg AY. Treatment of Acinetobacter infections. Clin Infect Dis. 2010 Jul;51(1):79-84.
- Penwell WF, Shapiro AB, Giacobbe RA. et al. Molecular mechanisms of sulbactam antibacterial activity and resistance determinants in Acinetobacter baumannii. Antimicrob Agents Chemother. 2015 Mar;59(3):1680-1689.
- Isler B, Doi Y, Bonomo RA, Paterson DL. New Treatment Options against Carbapenem-Resistant Acinetobacter baumannii Infections. Antimicrob Agents Chemother. 2019 Dec;63(1):e01110-18.
- Chang YY, Yang YS, Wu SL. et al. Comparison of Cefepime-Cefpirome and Carbapenem Therapy for Acinetobacter Bloodstream Infection in a Multicenter Study. Antimicrob Agents Chemother. 2020 May;64(6):e02392-19.
- Piperaki ET, Tzouvelekis LS, Miriagou V, Daikos GL. Carbapenem-resistant Acinetobacter baumannii: in pursuit of an effective treatment. Clin Microbiol Infect. 2019 Aug;25(8):951-957.
- Ritchie DJ, Garavaglia-Wilson A. A review of intravenous minocycline for treatment of multidrug-resistant Acinetobacter infections. Clin Infect Dis. 2014 Dec;59 Suppl 6:S374-80.
- Durante-Mangoni E, Signoriello G, Andini R. et al. Colistin and rifampicin compared with colistin alone for the treatment of serious infections due to extensively drug-resistant Acinetobacter baumannii: a multicenter, randomized clinical trial. Clin Infect Dis. 2013 Aug;57(3):349-358.
- Park HJ, Cho JH, Kim HJ, Han SH, Jeong SH, Byun MK. Colistin monotherapy versus colistin/rifampicin combination therapy in pneumonia caused by colistin-resistant Acinetobacter baumannii: A randomised controlled trial. J Glob Antimicrob Resist. 2019 Jun;17:66-71.
- Kaye KS, Marchaim D, Thamlikitkul V, et al. Colistin Monotherapy versus Combination Therapy for Carbapenem-Resistant Organisms. NEJM Evid 2023;2.
- Aydemir H, Akduman D, Piskin N. et al. Colistin vs. the combination of colistin and rifampicin for the treatment of carbapenem-resistant Acinetobacter baumannii ventilator-associated pneumonia. Epidemiol Infect. 2013 Jun;141(6):1214-1222.
- Sirijatuphat R, Thamlikitkul V. Preliminary study of colistin versus colistin plus fosfomycin for treatment of carbapenem-resistant Acinetobacter baumannii infections. Antimicrob Agents Chemother. 2014 Sep;58(9):5598-5601.
- Perez F, Adachi J, Bonomo RA. Antibiotic-resistant gram-negative bacterial infections in patients with cancer. Clin Infect Dis. 2014 Nov;59 Suppl 5:S335-9.
- Kengkla K, Kongpakwattana K, Saokaew S, Apisarnthanarak A, Chaiyakunapruk N. Comparative efficacy and safety of treatment options for MDR and XDR Acinetobacter baumannii infections: a systematic review and network meta-analysis. J Antimicrob Chemother. 2018 Jan;73(1):22-32.
- Chen H, Liu Q, Chen Z, Li C. Efficacy of sulbactam for the treatment of Acinetobacter baumannii complex infection: A systematic review and meta-analysis. J Infect Chemother. 2017 May;23(5):278-285.
- Jaruratanasirikul S, Wongpoowarak W, Aeinlang N, Jullangkoon M. Pharmacodynamics modeling to optimize dosage regimens of sulbactam. Antimicrob Agents Chemother. 2013 Jul;57(7):3441-3444.
- Jaruratanasirikul S, Wongpoowarak W, Wattanavijitkul T. et al. Population Pharmacokinetics and Pharmacodynamics Modeling To Optimize Dosage Regimens of Sulbactam in Critically Ill Patients with Severe Sepsis Caused by Acinetobacter baumannii. Antimicrob Agents Chemother. 2016 Nov;60(12):7236-7244.
- Brooke JS. Stenotrophomonas maltophilia: an emerging global opportunistic pathogen. Clin Microbiol Rev. 2012 Jan;25(1):2-41.
- rooke JS. Advances in the Microbiology of Stenotrophomonas maltophilia. Clin Microbiol Rev. 2021 Jul;34(3):e0003019.
- Safdar A, Rolston KV. Stenotrophomonas maltophilia: changing spectrum of a serious bacterial pathogen in patients with cancer. Clin Infect Dis. 2007 Dec;45(12):1602-1609.
- Kim SH, Cha MK, Kang CI. et al. Pathogenic significance of hemorrhagic pneumonia in hematologic malignancy patients with Stenotrophomonas maltophilia bacteremia: clinical and microbiological analysis. Eur J Clin Microbiol Infect Dis. 2019 Feb;38(2):285-295.
- Araoka H, Fujii T, Izutsu K. et al. Rapidly progressive fatal hemorrhagic pneumonia caused by Stenotrophomonas maltophilia in hematologic malignancy. Transpl Infect Dis. 2012 Aug;14(4):355-363.
- EUCAST Clinical Breakpoints v 13.0.
- Cairo J, Hachem R, Rangaraj G, Granwehr B, Raad I. Predictors of catheter-related gram-negative bacilli bacteraemia among cancer patients. Clin Microbiol Infect. 2011 Nov;17(11):1711-1716.
- Mojica MF, Humphries R, Lipuma JJ. et al. Clinical challenges treating Stenotrophomonas maltophilia infections: an update. JAC Antimicrob Resist. 2022 May;4(3):dlac040.
- Tamma PD, Avdic E, Li DX, Dzintars K, Cosgrove SE. Association of Adverse Events With Antibiotic Use in Hospitalized Patients. JAMA Intern Med. 2017 Sep;177(9):1308-1315.
- Cho SY, Kang CI, Kim J. et al. Can levofloxacin be a useful alternative to trimethoprim-sulfamethoxazole for treating Stenotrophomonas maltophilia bacteremia? Antimicrob Agents Chemother. 2014;58(1):581-3.
- Nys C, Cherabuddi K, Venugopalan V, Klinker KP. Clinical and Microbiologic Outcomes in Patients with Monomicrobial Stenotrophomonas maltophilia Infections. Antimicrob Agents Chemother. 2019 Oct;63(11):e00788-19.
- Shah MD, Coe KE, El Boghdadly Z. et al. Efficacy of combination therapy versus monotherapy in the treatment of Stenotrophomonas maltophilia pneumonia. J Antimicrob Chemother. 2019 Jul;74(7):2055-2059.
- 石井良和. 薬剤感受性試験とブレイクポイント,その問題点と今後の展望. 日本化学療法学会雑誌 2011:454-9.
- Magill SS, O'Leary E, Janelle SJ. et al. Changes in Prevalence of Health Care-Associated Infections in U.S. Hospitals. N Engl J Med. 2018 Nov;379(18):1732-1744.
- Marra AR, Perencevich EN, Nelson RE. et al. Incidence and Outcomes Associated With Clostridium difficile Infections: A Systematic Review and Meta-analysis. JAMA Netw Open. 2020 Jan;3(1):e1917597.
- Kato H, Senoh M, Honda H. et al. Clostridioides (Clostridium) difficile infection burden in Japan: A multicenter prospective study. Anaerobe. 2019Dec;60:102011.
- Lessa FC, Mu Y, Bamberg WM. et al. Burden of Clostridium difficile infection in the United States. N Engl J Med. 2015 Feb;372(9):825-834.
- Kociolek LK, Gerding DN, Carrico R. et al. Strategies to prevent Clostridioides difficile infections in acute-care hospitals: 2022 Update. Infect Control Hosp Epidemiol. 2023 Apr;44(4):527-549.
- Clostridioides difficile 感染症診療ガイドライン 公益社団法人日本化学療法学会・一般社団法人日本感染症学会 CDI 診療ガイドライン作成委員会編. 2022. at https://www.kansensho.or.jp/uploads/files/guidelines/guideline_cdi_230125.pdf.)
- Keessen EC, Hensgens MP, Spigaglia P. et al. Antimicrobial susceptibility profiles of human and piglet Clostridium difficile PCR-ribotype 078. Antimicrob Resist Infect Control. 2013 Apr;2:14.
- Privitera G, Scarpellini P, Ortisi G, Nicastro G, Nicolin R, de Lalla F. Prospective study of Clostridium difficile intestinal colonization and disease following single-dose antibiotic prophylaxis in surgery. Antimicrob Agents Chemother. 1991 Jan;35(1):208-210.
- Finn E, Andersson FL, Madin-Warburton M. Burden of Clostridioides difficile infection (CDI) - a systematic review of the epidemiology of primary and recurrent CDI. BMC Infect Dis. 2021 May;21(1):456.
- van Prehn J, Reigadas E, Vogelzang EH. et al. European Society of Clinical Microbiology and Infectious Diseases: 2021 update on the treatment guidance document for Clostridioides difficile infection in adults. Clin Microbiol Infect. 2021 Dec;27 Suppl 2:S1-S21.
- Polage CR, Gyorke CE, Kennedy MA. et al. Overdiagnosis of Clostridium difficile Infection in the Molecular Test Era. JAMA Intern Med. 2015 Nov;175(11):1792-1801.
- ohnson S, Lavergne V, Skinner AM. et al. Clinical Practice Guideline by the Infectious Diseases Society of America (IDSA) and Society for Healthcare Epidemiology of America (SHEA): 2021 Focused Update Guidelines on Management of Clostridioides difficile Infection in Adults. Clin Infect Dis. 2021 Sep;73(5):755-757.
- Figueroa I, Johnson S, Sambol SP, Goldstein EJ, Citron DM, Gerding DN. Relapse versus reinfection: recurrent Clostridium difficile infection following treatment with fidaxomicin or vancomycin. Clin Infect Dis. 2012 Aug;55 Suppl 2:S104-9.
- Johnson S. Recurrent Clostridium difficile infection: causality and therapeutic approaches. Int J Antimicrob Agents. 2009 Mar;33 Suppl 1:S33-6.
- Pepin J, Routhier S, Gagnon S, Brazeau I. Management and outcomes of a first recurrence of Clostridium difficile-associated disease in Quebec, Canada. Clin Infect Dis. 2006 Mar;42(6):758-764.
- McFarland LV, Elmer GW, Surawicz CM. Breaking the cycle: treatment strategies for 163 cases of recurrent Clostridium difficile disease. Am J Gastroenterol. 2002 Jul;97(7):1769-1775.
- Okumura H, Fukushima A, Taieb V, Shoji S, English M. Fidaxomicin compared with vancomycin and metronidazole for the treatment of Clostridioides (Clostridium) difficile infection: A network meta-analysis. J Infect Chemother. 2020 Jan;26(1):43-50.
- Tashiro S, Mihara T, Sasaki M. et al. Oral fidaxomicin versus vancomycin for the treatment of Clostridioides difficile infection: A systematic review and meta-analysis of randomized controlled trials. J Infect Chemother. 2022 Nov;28(11):1536-1545.
- Probiotics revisited. JAMA. 2014 Nov;312(5):1796.
- Clancy CJ, Nguyen MH. Diagnosing Invasive Candidiasis. J Clin Microbiol. 2018 Apr;56(5):e01909-17.
- Calandra T, Roberts JA, Antonelli M, Bassetti M, Vincent JL. Diagnosis and management of invasive candidiasis in the ICU: an updated approach to an old enemy. Crit Care. 2016 May;20(1):125.
- Bassetti M, Mikulska M, Viscoli C. Bench-to-bedside review: therapeutic management of invasive candidiasis in the intensive care unit. Crit Care. 2010;14(6):244.
- Kullberg BJ, Arendrup MC. Invasive Candidiasis. N Engl J Med. 2015 Oct;373(15):1445-1456.
- Jeffery-Smith A, Taori SK, Schelenz S. et al. Candida auris: a Review of the Literature. Clin Microbiol Rev. 2017 Nov;31(1):e00029-17
- Karageorgopoulos DE, Vouloumanou EK, Ntziora F, Michalopoulos A, Rafailidis PI, Falagas ME. beta-D-glucan assay for the diagnosis of invasive fungal infections: a meta-analysis. Clin Infect Dis. 2011 Mar;52(6):750-770.
- Onishi A, Sugiyama D, Kogata Y. et al. Diagnostic accuracy of serum 1,3-beta-D-glucan for pneumocystis jiroveci pneumonia, invasive candidiasis, and invasive aspergillosis: systematic review and meta-analysis. J Clin Microbiol. 2012 Jan;50(1):7-15.
- 吉田耕一郎, 二木芳人 深在性真菌症診断とβ-D-グルカン値測定 日集中医誌 2010;17:1.
- Leon C, Ruiz-Santana S, Saavedra P. et al. A bedside scoring system ("Candida score") for early antifungal treatment in nonneutropenic critically ill patients with Candida colonization. Crit Care Med. 2006 Mar;34(3):730-7.
- 日本医真菌学会 侵襲性カンジダ症の診断・診療ガイドライン. Med Mycol J. 2013;54(2):147-251.
- Pappas PG, Kauffman CA, Andes DR. et al. Clinical Practice Guideline for the Management of Candidiasis: 2016 Update by the Infectious Diseases Society of America. Clin Infect Dis. 2016 Feb;62(4):e1-50.
- Demir KK, Butler-Laporte G, Del Corpo O. et al. Comparative effectiveness of amphotericin B, azoles and echinocandins in the treatment of candidemia and invasive candidiasis: A systematic review and network meta-analysis. Mycoses. 2021 Sep;64(9):1098-1110.
- Ishikane M, Hayakawa K, Kutsuna S, Takeshita N, Ohmagari N. The impact of infectious disease consultation in candidemia in a tertiary care hospital in Japan over 12 years. PLoS One. 2019 Apr;14(4):e0215996.